
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение электронных оболочек атомов
|
|
|
|
Решение систем уравнений, состоящих из уравнений Шредингера, потенциальной энергии и граничных условий, описывает полные энергии Е и волновые функции Ψ всех возможных орбиталей атома. Но это решение не отвечает на целый ряд вопросов, без ответов на которые нельзя представить строение многоэлектронного атома. Среди таких вопросов важнейшими являются два:
1. Сколько электронов способны вместить одна орбиталь, один подуровень и один уровень?
2. В какой последовательности заполняются орбитали, подуровни и уровни?
Ответы на эти вопросы дают принцип Паули, принцип минимума энергии и правило Хунда.
Принцип Паули. Этот принцип сформулирован в 1925 г. В. Паули:
в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Принцип Паули определяет прежде всего максимальную емкость по электронам одной орбитали Nm. Так как орбиталь определяется тремя первыми квантовыми числами п, l и т, электроны данной орбитали могут различаться только спиновым квантовым числом s. Но s может приобретать только два значения: + 1/2 и –1/2, поэтому максимальная емкость любой орбитали Nm = 2 т. е. на ней могут находиться два электрона, один электрон или же она может быть вакантной, пустой.
Этот же принцип определяет электронную емкость подуровней и уровней. Подуровень l имеет 2 l + 1 орбиталей, так как магнитное квантовое число может приобретать все целочисленные значения от – l до + l, включая 0. Отсюда предельная, максимальная емкость подуровня Nl равна:
Nl = 2(2 l+ 1)
Максимальная емкость уровня по электронам Nn суммируется из величин Nl подуровней этого уровня. Эти величины Nl образуют арифметическую прогрессию по величинам l. Как известно, сумма членов арифметической прогрессии равна половине произведения числа членов прогрессии на сумму первого и последнего членов. Отсюда
Nn = 2 n 2
Следовательно подуровни s, р, d и f и уровни с главными квантовыми числами п = 1, 2, 3, 4,... всегда имеют одну и ту же предельную емкость по электронам.
Принцип минимума энергии. Этот общефизический принцип определяет, что наиболее устойчивыми состояниями любой системы, в частности атома или молекулы, являются состояния с минимальным запасом энергии. Применительно к атому этот принцип означает, что электроны в атоме заполняют уровни с наименьшими значениями главного квантового числа n, а в пределах уровня сначала заполняются подуровни с наименьшими значениями орбитального квантового числа l.
Правила Хунда. Если подуровень имеет не одну, а несколько орбиталей, то электроны атома, находящегося в основном состоянии, могут занимать эти энергетические равноценные орбитали лишь в определенном порядке, следуя правилам Хунда:
1. Электроны избегают занимать одну и ту же орбиталь настолько, насколько это совместимо с принципом минимума энергии.
2. Электроны, поодиночке занимающие орбитали одного и того же подуровня, имеют одинаковые спины.
Если учесть взаимное расположение орбиталей в пространстве, первое правило Хунда приобретает простой физический смысл: электроны одного подуровня, отталкиваясь друг от друга, стремятся занять по возможности удаленные друг от друга, т. е. разные, орбитали подуровня. Второе правило Хунда также имеет энергетическую основу, т. е. является проявлением принципа минимума энергии
Электронные формулы. Они фиксируют занятые электронами подуровни и число электронов на них. В электронных формулах первым, цифровым символом обозначают номер уровня, а вторым, буквенным, символом (s, p, d, f) обозначают номер подуровня. Число электронов на подуровне обозначают верхним правым индексом. Например, для основного невозбужденного состояния атома водорода электронная формула выглядит так: 1 s 1. Это обозначает, что на подуровне s первого энергетического уровня находится один электрон. Электронная формула азота: 1 s 22 s 22 p 3, т.е. на подуровнях I s и 2 s в атоме азота находится по два электрона, а на подуровне 2 р находятся три электрона. Сумма верхних индексов электронной формулы должна быть равна общему числу электронов в атоме. Для атома азота эта сумма 2 + 2 + 3 = 7.
Электронно-структурные формулы изображают атом элемента в виде совокупности орбиталей, которые называют также квантовыми ячейками
Орбитали группируются в подуровни и уровни с учетом значений полной энергии. Например, для всех атомов, имеющих в невозбужденном состоянии два энергетических уровня, электронно-структурные формулы включают пять орбиталей: одну s -орбиталь на первом энергетическом уровне, одну s - и три р -орбитали на втором энергетическом уровне (рисунок 2.5).
Заполнение орбиталей-ячеек электронами осуществляется в соответствии с принципами Паули, минимизации энергии и правилами Хунда. Выполнение правила Хунда при заполнении орбиталей атома азота (рисунок 6) можно проследить на примере p -подуровня, на трех орбиталях которого электроны размещаются по одному и имеют параллельные спины атома
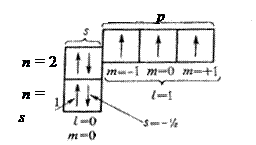
Рисунок 2.5– Электронно-структурная формула
азота . Химические свойства атомов определяются в основном строением наружных электронных уровней, которые называют валентными. Заполненные энергетические подуровни, соответствующие электронным структурам атомов благородных газов, называют электронным остовом. Например, для атома натрия, имеющего электронную формулу 1 s2 2 s 22 p 63 s 1, электронный остов образуют целиком заполненные подуровни 1 s, 2 s, 2 p, которые соответствуют электронной структуре благородного газа неона: 1 s 22 s 22 p 6. Сокращенно электронную формулу благородного газа обозначают его химическим символом в квадратных скобках, например: 1 s22s2 2 p 6 = [Ne]. Это позволяет упростить запись электронных формул, например для калия вместо 1 s 22 s 22 p 63 s 23 p 4 s lможно написать [Ar]4 s 1. Одновременно сокращенная запись наглядно выделяет валентные электроны, определяющие химические свойства атомов элемента.
. Химические свойства атомов определяются в основном строением наружных электронных уровней, которые называют валентными. Заполненные энергетические подуровни, соответствующие электронным структурам атомов благородных газов, называют электронным остовом. Например, для атома натрия, имеющего электронную формулу 1 s2 2 s 22 p 63 s 1, электронный остов образуют целиком заполненные подуровни 1 s, 2 s, 2 p, которые соответствуют электронной структуре благородного газа неона: 1 s 22 s 22 p 6. Сокращенно электронную формулу благородного газа обозначают его химическим символом в квадратных скобках, например: 1 s22s2 2 p 6 = [Ne]. Это позволяет упростить запись электронных формул, например для калия вместо 1 s 22 s 22 p 63 s 23 p 4 s lможно написать [Ar]4 s 1. Одновременно сокращенная запись наглядно выделяет валентные электроны, определяющие химические свойства атомов элемента.
Следует отметить, что в электронно-структурных формулах в отличие от электронных изображают не только заполненные, но и вакантные орбитали валентных подуровней. Это позволяет предсказать изменение валентности элемента в результате перехода его атома в возбужденное.
Согласно спиновой теории валентности, разработанной Гейтлером и Лондоном неспаренные электроны валентны, т.е. способны участвовать в образовании химической связи. Количественно валентность равна числу неспаренных электронов. Спаренные электроны невалентны, однако могут становиться валентными.
Например: углерод согласно электронно-структурной формуле двухвалентен (имеет два неспаренных электрона). Но в большинстве химических соединений он 4-х валентен. Для проявления такой валентности атом углерода необходимо перевести в возбужденное состояние, сообщая ему энергию. При этом один из s -электронов 2-го уровня перескакивает на 
свободную p -орбиталь:
Атом в возбужденном состоянии обозначают символом соответствующего элемента со звездочкой, например C*. При переходе атома в возбужденное состояние происходит распаривание электронов более низкого электронного подуровня и переход их на более высокий подуровень.
Обычно электронные слои, предшествующие наружному (так называемый электронный остов) не показывают и электронно-структурную формулу записывают:



У атомов, обладающих электронной конфигурацией полностью заполненных подуровней (s 2, p 6, d 10, f 14) нет холостых невозбужденных электронов и валентность их равна нулю.
Образование валентных электронов у таких атомов является единственно следствием возбуждения атома.
Для атомов некоторых элементов имеет место многократное последовательное возбуждение с соответствующим изменением валентности, например для серы:
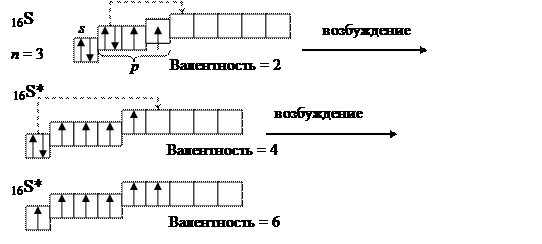
Валентность серы в основном состоянии равняется двум (CS2) в возбужденном четырем и шести (SCl4,, SF6).
|
|
|
Дата добавления: 2014-01-13; Просмотров: 2827; Нарушение авторских прав?; Мы поможем в написании вашей работы!