
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантово-механические принципы строения вещества
|
|
|
|
Квантовая механика базируется на двух основных гипотезах, которые были предложены в 1924-1926 гг. французским физиком Л. де Бройлем и немецким физиком В. Гейзенбергом. В 1924 г. де Бройль высказал предположение, что все частицы (электроны, протоны, α-частицы) обладают волновыми свойствами и каждой движущейся частице соответствует электромагнитная волна. Длина волны электрона связана с его импульсом соотношением
λ = h/mv
Это уравнение можно использовать для расчета длин волн любого движущегося с определенной скоростью тела. Согласно вычислениям, для тел массой 1 г и больше, движущихся с обычными скоростями (порядка м/с), длины волн настолько малы, что их нельзя измерить. Однако электронам, имеющим бóльшие скорости (106-107 м/с), соответствуют длины волн, сравнимые с межатомными расстояниями в кристаллах. В 1927 г. К. Дэвиссон и Л. Джермер подтвердили положения де Бройля экспериментально, показав, что пучок электронов рассеивается кристаллом никеля точно так же, как рассеивается рентгеновское излучение. Иначе говоря, атомы в кристалле служат дифракционной решеткой для электронов так же, как и для квантов рентгеновского излучения.
Применяя свою гипотезу для объяснения строения атома, де Бройль высказал мысль, что на устойчивых орбитах, рассчитанных по теории Бора, должно укладываться целое число электронных волн. И действительно, на 1-й электронной орбите атома водорода в соответствии с расчетом укладывается одна волна де Бройля, на 2-й - две, на 3-й - три и т.д., т.е. движение электрона по стационарной орбите может быть описано уравнением стоячей волны.
Вторым основным принципом квантовой механики является принцип неопределенности Гейзенберга, согласно которому невозможно одновременно определить точно импульс и положение частицы, а также энергию системы в тот или иной момент времени. Математически это может быть выражено неравенством
Δ x· Δ(mvx) ≥ h/ 2π,
где Δ x - неопределенность в определении положения частицы; Δ(mvx) -неопределенность в соответствующей составляющей ее импульса.
Австрийский физик Э. Шрёдингер использовал волновое уравнение в качестве модели для описания поведения электрона в атоме. Эта модель учитывает также принцип неопределенности.
Уравнение Шредингера.
Это фундаментальное уравнение квантовой механики связывает полную энергию частицы Е, равную сумме потенциальной и кинетической энергий, потенциальную энергию U, массу частицы т и волновую функцию Ψ. Для одной частицы, например электрона массой те, оно имеет следующий вид:
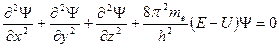
С математической точки зрения это уравнение с тремя неизвестными: Ψ Е и U. Решить его, т. е. найти эти неизвестные, можно, если решать его совместно с двумя другими уравнениями (для нахождения трех неизвестных требуется три уравнения). В качестве таких уравнений используют уравнения для потенциальной энергии и граничных условий.
Остановимся на смысле Ψ-функции в уравнении Шрёдингера. Поскольку Ψ в волновом уравнении является трехмерным аналогом амплитуды плоской волны, то Ψ-функция определяется как амплитудная функция. Ей нельзя приписать какой-либо физический смысл, но Ψ 2 d τ, где d τ- элемент объема пространства атома, определяет вероятность нахождения электрона в данном объеме.
Уравнение потенциальной энергии не содержит волновую функцию Ψ. Оно описывает взаимодействие заряженных частиц по закону Кулона. При взаимодействии одного электрона с ядром, имеющим заряд +z, потенциальная энергия равна:
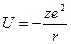
где  .
.
Это случай так называемого одноэлектронного атома. В более сложных системах, когда заряженных частиц много, уравнение потенциальной энергии состоит из суммы таких же кулоновских членов.
Уравнением граничных условий является выражение Ψ → 0, если r → ∞.
Оно означает, что волновая функция электрона стремится к нулю на больших расстояниях от ядра атома.
Решение уравнения Шредингера позволяет найти волновую функцию электрона Ψ(х, у, z) как функцию координат. Это распределение Ψ называется орбиталью. Другими словами, орбиталь - это заданная в пространстве волновая функция Ψ (x, у, z), определяющая область наиболее вероятного нахождения и энергетический уровень электрона в атоме.
Система уравнений, включающая уравнения Шредингера, потенциальной энергии и граничных условий, имеет не одно, а много решений. Каждое из решений одновременно включает Ψ(х, у, z) и Е, т. е. описывает электронное облако и соответствующую ему полную энергию. Каждое из решений определяется квантовыми числами.
Физический смысл квантовых чисел можно понять, рассмотрев колебания струны, в результате которых образуется стоячая волна (рисунок 2.2).
|
|
|
|
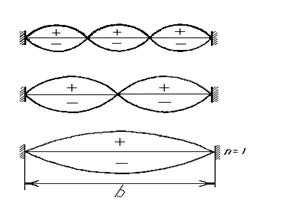
Рисунок 2.2 – Стоячие волны в натянутой струне
Длина стоячей волны λ и длина струны b связаны уравнением
λ = 2b/п.
Длина стоячей волны может иметь лишь строго определенные значения, отвечающие числу п, которое принимает только целочисленные неотрицательные значения 1, 2, 3 и т. д. Как видно из рис. 2, число максимумов амплитуды колебаний, т. е. форма стоячей волны, однозначно определяется значением п.
Поскольку электронная волна в атоме представляет собой более сложный процесс, чем стоячая волна струны, значения волновой функции электрона определяются не одним, а четырьмя числами, которые Называются квантовыми числами и обозначаются буквами n, l, m и s. Данному набору квантовых чисел п, l, m одновременно отвечают определенная волновая функция Ψ n,l,m и полная энергия En,l. Квантовое число m при E неуказывают, так как в отсутствие внешнего поля E от него не зависит. Квантовое число s не влияет ни на Ψ n,l,m, ни на En,l.
Квантовые числа электрона. Главное квантовое число (n) может принимать любые целочисленные значения: n = 1, 2, 3, …. Определяет орбитальный радиус r ор и соответствующий главный энергетический уровень En.
Орбитальным радиусом rор называют расстояние от ядра атома до наиболее удаленной точки поверхности, изображающей атомную орбиталь.
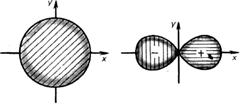
Для сферической поверхности орбитальный радиус равен радиусу сферы. Для поверхности в виде песочных часов орбитальный радиус равен диаметру одной из составляющих сфер (рисунок 2.3).
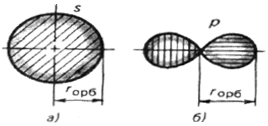
Рисунок 2.3 –Определение орбитального радиуса r ор для атомных орбиталей разной формы:
а — s -орбиталь; б — p -орбиталь
Главным энергетическим уровнем называют часть энергии атома, определяемой квантовым числом n.
Для обозначения уровней часто употребляют прописные буквы латинского алфавита K, L, M, N, O, P, Q. Первый уровень (n = 1) называют K -уровнем, второй (n = 2) – L -уровнем и т.д.
Энергия притяжения между электроном и ядром уменьшается обратно пропорционально квадрату главного квантового числа п, а орбитальный радиус r ор увеличивается пропорционально этой величине. С увеличением числа п электрон в среднем находится все дальше от ядра. При п → ∞ энергия притяжения становится равной нулю, электрон отрывается от ядра. Происходит ионизация атома.
Весьма существенно, что энергия электрона может принимать не любые, а лишь строго определенные дискретные значения En. Это явление называется квантованием энергии. В результате атом поглощает и излучает энергию порциями - квантами, частота которых определяется по формуле Планка.
Каждому уровню энергии Еп соответствует характерная область пространства с орбитальным радиусом rп. В этой области преимущественно движется электрон. Такое явление называется квантованием пространства. В отличие от теории Бора эти принципиально важные результаты в квантовой механике получают без каких-либо дополнительных постулатов решением уравнения Шредингера.
Орбитальное квантовое число (l). Число l может принимать целочисленные значения: l = 0, 1, 2,..., п – 1, т. е. максимальное значение l не превышает п – 1, где п — главное квантовое число.
Величина l определяет форму атомной орбитали и орбитальный подуровень энергии Enl главного энергетического уровня атома при данном п.
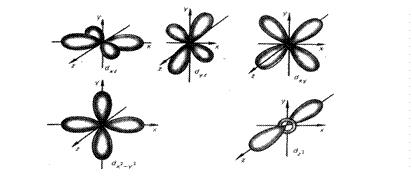
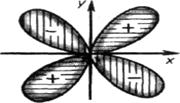
При l = 0 форма орбитали сферическая и называется s-орбиталью. При l = 1 орбиталь имеет форму песочных часов (гантели) и называется р-орбиталью. При l = 2форма орбитали - четырехлопастная и называется d-орбиталью (рисунок 2.4). У p -орбиталей имеется узел, а у d -орбиталей - узловые плоскости, где волновые функции равны нулю. Знаки лопастей чередуются.
s: l = 0 p: l = 1
d: l = 2
Рисунок 2.4 – Пространственная форма s-, p-, d -атомных орбиталей
При п = 1 имеется только одна l s -орбиталь (l = 0) и отсутствуют другие подуровни энергии и орбитали.
При п = 2 имеются 2 s -орбиталь(l = 0) и 2р -орбитали (l= 1) разной ориентации. Им соответствуют энергетические подуровни E2s, E2p.
При n = 3 имеются 3 s -орбиталь (l = 0), 3 p -(l = 1)и 3 d -(l = 3) орбитали разных ориентаций. Им соответствуют энергетические подуровни E 3 s, Е 3 р , Е 3 d.
Размер атомных орбиталей разной формы возрастает с увеличением п.
Магнитное квантовое число (т). Число т принимает целочисленные значения: 0, ± 1, ± 2,..., ± l. Эти значения определяют ориентацию орбиталей в пространстве, их число на данном орбитальном подуровне Enl и магнитный энергетический подуровень Enlm. На каждом орбитальном подуровне Епр (1= 1) имеется три пр- орбитали с ориентацией вдоль осей х, у, z. Например, при п = 2 подуровню E 21 (l = l) соответствуют орбитали 2 рх (т= +1), 2 py (m = –1) и 2 рг (т = 0). При n = 3 подуровню E 32 (l = 2) отвечают пять орбиталей разных ориентации.
Спиновое квантовое число (s). Число s принимает два значения: +1/2 и –1/2. Характеризует собственное вращательное движение электрона. На каждой атомной орбитали двум значениям s = ±1/2 отвечает вращение по часовой и против часовой стрелки. Соответственно имеются два спиновых подуровня энергии Enlms.
Четыре квантовых числа n, l, m, и s характеризуют различные типы пространственного квантования при движении одного электрона в атоме и определяют соответствующие квантовые энергетические уровни.
Орбиталь и соответствующий энергетический уровень, определяемые четырьмя квантовыми числами п, l, m, s, называют квантовым состоянием электрона в атоме.
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 674; Нарушение авторских прав?; Мы поможем в написании вашей работы!
