
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные сведения о строении атома
|
|
|
|
СТРОЕНИЕ ВЕЩЕСТВА
ЛЕКЦИЯ 2
Понятие атома как мельчайшей неделимой частицы вещества было предложено в V–VI вв. до н. э. греческими философами Левкиппом и Демокритом. Согласно Демокриту – Вселенная это движущаяся материя, атомы веществ и пустота. Вечно движущиеся атомы, соединяясь, создают все вещи. Каждый атом неделим, конечен и имеет определенную форму. Атомы настолько малы, что чувственно не воспринимаемы. Различие в видах атомов, составляющих тело, и в их взаимном расположении определяет несходство состоящих из атомов тел. Атомы имеют разные размеры и форму и находятся в вечном движении, сталкивании, отталкивании и первичном движении – вибрации. Хотя в основе этих представлений чисто умозрительные соображения, справедливость многих из них не отрицается наукой и сегодня.
В дальнейшем представление об атомном строении вещества было заменено теорией элементов Аристотеля. Лишь в XVI в. Джордано Бруно вновь вернулся к понятию атома. Дж. Дальтон (1803 г.) связал количественный состав вещества с его атомным составом (закон кратных отношений), но только на 1-м Международном химическом конгрессе (1860 г.) атомная теория получила всеобщее признание. Вплоть до конца XIX в. атом рассматривался как неделимая частица.
Экспериментальные факты, свидетельствовавшие о сложной структуре атома, были получены при исследовании электролиза, природы катодных и каналовых лучей, радиоактивности элементов и оптических спектров атомов. Было установлено, что все атомы содержат электроны - мельчайшие частицы, имеющие массу mе = 9,109×10–31 кг и заряд е = 1,602×10–19 Кл. Поскольку в своем нормальном состоянии атом – частица нейтральная, естественно было допустить, что, кроме электронов, он содержит и положительные заряды. В 1903 г. Дж. Томсон предложил первую (капельную) модель атома. Согласно этой модели, положительный заряд распределен равномерно по всему объему атома, а нейтрализуется он электронами, «плавающими в этом море положительного электричества». Последующие исследования опровергли точку зрения Томсона.
Основную роль в создании планетарной модели атома сыграли опыты Э. Резерфорда по изучению рассеяния α-частиц тонкими листками слюды. Аналогичные эксперименты провели его сотрудники X. Гейгер и Э. Марсден, используя в качестве рассеивающего вещества золотую фольгу.
Схема эксперимента приведена на рисунке 2.1. Источник α-излучения помещали в свинцовый кубик К с просверленным в нем каналом, чтобы получить поток α-частиц летящих в определенном направлении. Попадая на экран Э, покрытый ZnS, α-частицы вызывали его свечение, причем в лупу Л можно было увидеть и подсчитать отдельные вспышки при попадании α-частиц. Между источником излучения и экраном помещали тонкую металлическую фольгу М (выполненную из золота, толщиной ~2000 атомов). Перемещая экран по дуге Д можно было фиксировать рассеяние α-частиц при прохождении через фольгу.
Оказалось, что большинство α-частиц проходит через фольгу не изменяя своего направления и только очень незначительная часть изменяет его, причем отдельные частицы изменяли направление очень резко или даже отбрасывались назад.
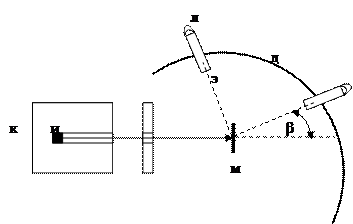
Рисунок 2.1 – Схема опыта Резерфорда
Результаты работ были опубликованы в 1909 г., а двумя годами позже Резерфорд дал теоретическое толкование результатов экспериментов. Он предположил, что большая часть массы атома и положительный заряд его сосредоточены в той части атома, которую он назвал ядром. Именно потому, что площадь, занимаемая ядром, очень мала (10–8 площади сечения атома) большинство α-частиц проходило через фольгу, не изменяя своей траектории, и только малая их доля отклонялась на углы более 90°. Резерфорд предложил принципиально новую, планетарную (ядерную) модель атома: в центре атома расположено тяжелое положительно заряженное ядро (размеры его ~10–12 см), вокруг которого вращаются электроны, подобно планетам вокруг Солнца.
Модель атома Резерфорда полностью объясняла опытные данные по рассеиванию α-частиц, но оставался неясным вопрос об устойчивости атома. Действительно, атом водорода, например, состоит из положительно заряженного ядра и одного электрона, вращающегося по круговой орбите. Такая система будет устойчивой при равенстве сил кулоновского притяжения электрона к ядру е2/r2 и центробежной силы mv2/r:
е2/ r2 = mv2/r, (1)
где т - масса электрона; r - радиус окружности, по которой движется электрон; и v - его скорость.
Однако это противоречит классической электродинамике, согласно которой заряженная частица, двигаясь с ускорением, должна излучать энергию в виде электромагнитных волн. Электрон движется по круговой орбите, т.е. с ускорением, следовательно, атом теряет энергию и электрон должен упасть на ядро.
Второй экспериментальный факт, который невозможно было объяснить исходя из модели атома Резерфорда, - это наличие у атомов и молекул, находящихся в газообразном состоянии, линейчатого спектра излучения. Если оптический спектр нагретого твердого или жидкого тела является непрерывным, например радуга-спектр солнечного излучения, то спектры газов состоят из отдельных узких линии с определенными, постоянными частотами для каждой линии.
В 1900 г. М. Планк, изучая спектры теплового излучения абсолютно черного тела, пришел к выводу, что энергия излучается атомами не непрерывно, а порциями - квантами, пропорциональными частоте ν:
E = h ν = hc/ λ
где с — скорость света, равная 3×108 м/с; h — постоянная Планка (6,62×10–34 Дж-с); λ— длина волны, м. Такой же вывод в 1905 г. сделал А. Эйнштейн, исследуя явление фотоэффекта.
В 1913 г. датский физик Н. Бор предложил теорию строения атома водорода, использовав при разработке ее планетарную модель атома Резерфорда и квантовую механику Планка. Эта теория основывается на двух постулатах.
Первый постулат утверждает, что электрон вращается вокруг ядра только по определенным стационарным орбитам. Когда электрон находится на стационарной орбите, атом пребывает в устойчивом состоянии - не поглощает и не излучает энергию. Если он располагается на ближайшей к ядру орбите, атом обладает минимальной энергией, и такое состояние называется основным, или невозбужденным. При переходе электрона на следующую или более дальние орбиты его энергия увеличивается, такое состояние атома называют возбужденным. Орбиты являются устойчивыми при условии, что момент количества движения электрона mvr равен целому числу квантов действия h /2π:
mvr = п (h/ 2π)
где п - некоторое число, которое может принимать любые целые значения от 1 до ∞. Число п Бор назвал главным квантовым числом. Решая совместно уравнения (1) и (2), находят радиусы стационарных орбит
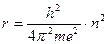
и соответствующие значения энергии
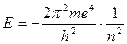 .
.
В основном состоянии (n =1) рассчитанный радиус атома водорода равен 0,53Å, что согласуется с экспериментальными данными.
Согласно второму постулату, при переходе электрона с одной стационарной орбиты на другую происходит поглощение или выделение энергии в виде электромагнитных волн. Каждому переходу соответствует своя частота, которая может быть рассчитана по формуле
 .
.
Но вскоре оказалось, что и теория Бора не универсальна, что она требует уточнения и развития. Во-первых, она не давала возможности точно рассчитать энергию многоэлектронных атомов, например атома гелия, молекулярного иона водорода Н2+. Во-вторых, появились экспериментальные факты, которые не могли быть объяснены в рамках этой теории. Так, по мере развития спектрографической техники было показано, что спектральные линии имеют тонкую структуру, состоят из нескольких близко расположенных линий, а при помещении излучающего атома в магнитное или электрическое поле спектральные линии расщепляются на более тонкие, близко расположенные спектральные линии. Поиски лучшей теории увенчались успехом – была разработана квантово-механическая модель атома.
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 806; Нарушение авторских прав?; Мы поможем в написании вашей работы!