
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции
|
|
|
|
Окисление первоначально рассматривалось как реакция присоединения кислорода к какому-либо веществу. Противоположный процесс – отнятие кислорода от вещества (или присоединение водорода к нему) – называли реакцией восстановления. Развитие электронной теории строения атомов и химической связи дало возможность широко обобщить представления об окислительно-восстановительных реакциях.
С современной точки зрения при окислительно-восстановительных реакциях происходит оттягивание электронов от одних атомов (окисление) и притягивание электронов к другим (восстановление). Например, при горении магния в кислороде 2Mg + О2 = 2MgO два валентных электрона атома магния оттягиваются и прочно удерживаются атомом кислорода, что, собственно, и приводит к образованию молекулы оксида магния.
Используя понятие об окислительном числе (см. выше, § 8), реакцию горения магния в кислороде можно выразить в электронной форме следующими уравнениями:
Mg0 – 2ē = Mg+2 (окисление)
1/2О2 + 2ē =О-2 (восстановление)
Из этих уравнений следует, что окисление магния – это процесс оттягивания от его атома двух валентных электронов атомом окислителя, в данном случае кислорода, который восстанавливается, принимая при этом отрицательную степень окисления.
Аналогичный процесс имеет место и при взаимодействии магния с рядом других элементарных веществ, атомы которых имеют значительное сродство к электрону. Например, магний сгорает в струе хлора, реагируя с ним, как и с кислородом, по уравнению
Mg + С12 = MgCl2
В электронной форме эта реакция записывается аналогичными уравнениями, как и для процесса взаимодействия магния с кислородом:
Mg0 – 2ē = Mg+2 (окисление)
С12 + 2ē = 2С1– (восстановление)
Здесь хлор является окислителем, а взаимодействие магния с хлором – реакцией окисления магния; атомы хлора, оттягивая электроны от атома магния, восстанавливаются, принимая отрицательную степень окисления.
При взаимодействии магния с соляной кислотой
Mg + 2НС1 = MgCl2 + Н2
также имеет место переход электронов от атома магния к иону водорода, который восстанавливается до элементарного водорода:
Mg0 – 2ē = Mg+2 (окисление)
2Н+ + 2ē = Н20 (восстановление)
В реакциях восстановления элементов из соединений происходят аналогичные процессы, что может быть показано на примере восстановления меди из ее оксида водородом:
СuО + Н2 = Сu + Н2О
или в электронной форме
Сu+2 + 2ē = Сu0 (восстановление)
Н20 – 2ē = 2Н+1 (окисление)
Элементарный водород, являющийся в этой реакции восстановителем, отдавая электроны, окисляется, принимая положительную степень окисления.
Рассмотрение этих и подобных им реакций приводит к заключению, что сущность реакции окисления заключается в отдаче электронов атомами окисляющегося элемента атомам восстанавливающегося элемента, которые, принимая электроны, восстанавливаются. Таким образом, сущность реакции восстановления заключается в присоединении электронов атомами восстанавливающегося элемента от атомов окисляющегося элемента, которые, отдавая электроны, окисляются. Очевидно, что реакция окисления неотделима от реакции восстановления и каждая из них составляет одну из двух неразрывно связанных стадий единого окислительно-восстановительного процесса.
Вещества, атомы которых в процессе реакции присоединяют электроны, называются окислителями, а вещества, атомы которых отдают свои электроны, называются восстановителями. Элементы, входящие в состав окислителей, восстанавливаются, и, наоборот, элементы, входящие в состав восстановителей, окисляются.
Происходящий при окислительно-восстановительных реакциях переход электронов от одних реагирующих атомов к другим сопровождается соответствующим изменением степени их окисления. По этому, собственно, признаку и устанавливается окислительно-восстановительный характер любой реакции.
Для определения окислительного числа химических элементов, входящих в состав различных веществ, рекомендованы простые и в то же время четкие правила, которые здесь могут быть дополнены следующими:
1. Окислительное число атомов кислорода в большинстве его соединений равно –2; исключения составляют соединения с фтором, в которых окислительное число кислорода положительно, и пероксиды, в которых оно равно –1.
2. Окислительное число водорода в соединениях его с окислительными элементами равно +1, а в соединениях с металлами –1.
3. В большинстве органических соединений полярность связи между атомами выражена слабо, но окислительные числа атомов в них определяются так же, как и в неорганических соединениях с полярной связью; в углеводородах, как соединениях с неполярной связью, степени окисления углерода и водорода, очевидно, равны нулю.
4. В любом сложном ионе алгебраическая сумма окислительных чисел всех атомов должна равняться заряду иона.
5. В ходе окислительно-восстановительных реакций окислительные числа окисляющихся элементов повышаются, а восстанавливающихся элементов – понижаются.
Окислительно-восстановительные реакции возможны только в тех случаях, если перемещающиеся от атома окисляющегося элемента электроны находятся на более высоком энергетическом уровне по сравнению с теми вакантными уровнями окислителя, на которые они переходят; перемещение происходит до тех пор, пока энергетические уровни в атомах обоих веществ не сравняются.
Для составления уравнений окислительно-восстановительных реакций необходимо знать окислительные и восстановительные свойства исходных и образующихся в реакции соединений, которые обычно устанавливаются экспериментально или на основе известных свойств элементов. Необходимо учитывать, что в окислительно-восстановительных реакциях происходит только эквивалентный обмен электронов между окислителем и восстановителем, т. е. суммарно числа электронов, теряемых восстановителем и приобретаемых окислителем, равны и никогда не образуется свободных электронов.
Применяют в основном два метода составления уравнений окислительно-восстановительных реакций: 1) электронного баланса; основанный на определении общего числа электронов, перемещающихся от восстановителя к окислителю, и 2) ионно-электронный, предусматривающий раздельное составление ионных уравнений для процесса окисления и для процесса восстановления с последующим суммированием их в общее ионное уравнение.
Рассмотрим последовательность приемов при составлении уравнений по методу электронного баланса, как более универсального, на примере реакции
H3N + О2 → NO + Н2О
Сначала надо определить и записать значения окислительных чисел тех элементов, у которых они изменяются в процессе реакции:
H3N–3 + О2 → N0 + Н2О
Затем следует определить изменения в значениях окислительных чисел, выявить восстановитель и окислитель и составить уравнения электронного баланса реакции. В ходе данной реакции окислительное число азота повысилось с –3 до + 2, т. е. азот окислился; следовательно, аммиак является восстановителем. Величина окислительного числа кислорода понизилась с 0 до –2, т. е. кислород восстановился и, следовательно, элементарный кислород является окислителем. Выявленное перемещение электронов записывается в виде электронного баланса реакции:
Множитель


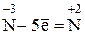 4 (окисление)
4 (окисление)
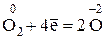 5 (восстановление)
5 (восстановление)
Учитывая, что электронный обмен является эквивалентным, общее число перемещающихся электронов определяется по правилам нахождения наименьшего кратного; в данной реакции, как это нетрудно видеть, оно равно 20. Найденные множители 4 и 5 являются коэффициентами перед формулами восстановителя и окислителя в левой части уравнения. Тогда схема уравнения реакции примет следующий вид:
4H3N-3 + 5О2 → 4N+2О-2 + Н2О-2
Выявление коэффициента перед формулой воды в правой части уравнения производится сопоставлением чисел атомов водорода и кислорода в левой и правой частях схемы. Очевидно, что перед формулой воды требуется поставить коэффициент 6. В окончательном виде получим следующее уравнение:
4H3N + 5О2 = 4NO + 6Н2О
Для установления отношений масс в окислительно-восстановительных реакциях принято пользоваться окислительными и восстановительными эквивалентами. Окислительный эквивалент – это масса окислителя, приходящаяся на единицу уменьшения степени окисления восстанавливающегося элемента. Восстановительный эквивалент – это масса восстановителя, приходящаяся на единицу увеличения степени окисления окисляющегося элемента.
Таким образом, в соответствии с определением окислительный и восстановительный эквиваленты равны значениям молей, деленным на число приобретенных или утраченных электронов. Так, например, для рассмотренной выше реакции окисления аммиака в оксид азота окислительный эквивалент кислорода равен его молярной массе, деленной на 4, т. е. 32/4 = 8 г. Восстановительный эквивалент аммиака соответственно равен его молярной массе, деленной на 5, т. е. 17,03/5 = 3,41 г.
В соответствии с законом эквивалентов окислители и восстановители реагируют между собой в количествах, пропорциональных их окислительным и восстановительным эквивалентам.
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 2903; Нарушение авторских прав?; Мы поможем в написании вашей работы!