
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантовые числа и их физический смысл
|
|
|
|
Как следует из решения уравнения Шредингера для атома водорода, квантовое состояние электрона в этом атоме (можно сказать и квантовое состояние атома) полностью определяется заданием трех квантовых чисел. Каждое из квантовых чисел принимает только целочисленные значения и определяет, то есть предсказывает результаты измерения основных физических величин в заданном квантовом состоянии атома.
1. Главное квантовое число 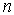 . Это квантовое число принимает значения
. Это квантовое число принимает значения
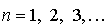
и определяет полную энергию электрона в любом квантовом состоянии
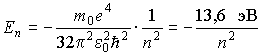
Можно отметить, что эти значения энергии являются собственными значениями гамильтониана в уравнении Шредингера для водородоподобного атома. Поэтому в связанном состоянии электрон в атоме водорода имеет дискретный энергетический спектр, лежащий в области отрицательных значений и имеющий точку сгущения  .
.
2. Орбитальное (азимутальное) квантовое число 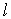 . В квантовых состояниях с заданным значением главного квантового числа
. В квантовых состояниях с заданным значением главного квантового числа  азимутальное квантовое число может иметь следующие значения:
азимутальное квантовое число может иметь следующие значения:
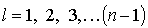 .
.
Стационарные волновые функции 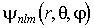 , описывающие различные квантовые состояния атома, являются собственными функциями не только оператора полной энергии
, описывающие различные квантовые состояния атома, являются собственными функциями не только оператора полной энергии 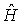 , но и оператора квадрата момента импульса
, но и оператора квадрата момента импульса 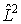 , причем
, причем
 .
.
Следовательно, в любом квантовом состоянии атом обладает определенным значением квадрата момента импульса, причем модуль орбитального момента импульса движущегося в атоме электрона однозначно определяется орбитальным квантовым числом:

Проанализируем эту формулу квантования момента импульса. Сравнивая ее с условием  квантования момента импульса движущегося электрона в теории Бора (3-й постулат Бора). Можно заметить, что эти условия не совпадают. И дело не только в отличии числовых значений, рассчитанных по этим формулам. Принципиальное отличие этих соотношений состоит в том, что в квантовой механике возможны состояния атома с нулевым моментом импульса. Во всех
квантования момента импульса движущегося электрона в теории Бора (3-й постулат Бора). Можно заметить, что эти условия не совпадают. И дело не только в отличии числовых значений, рассчитанных по этим формулам. Принципиальное отличие этих соотношений состоит в том, что в квантовой механике возможны состояния атома с нулевым моментом импульса. Во всех 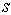 -состояниях и, частности, в основном
-состояниях и, частности, в основном  -состоянии, когда
-состоянии, когда  , по формуле
, по формуле  получаем
получаем  .
.
При классическом описании движения электрона в атоме по определенной траектории (орбите) в любом состоянии атом должен обладать ненулевым моментом импульса.
Опыт подтверждает существование квантовых состояний атома с нулевыми орбитальными моментами. Следовательно, опыт подтверждает, что только отказ от классического траекторного способа описания движения электрона в атоме позволяет правильно рассчитать и предсказать свойства атома. Вероятностный способ описания движения частиц в квантовой механике является единственно правильным способом описания свойств атомных систем - таков вывод современной физики.
Так как движущийся вокруг ядра электрон является заряженной частицей, то такое движение обуславливает протекание некоторого замкнутого тока в атоме, который можно охарактеризовать орбитальным магнитным моментом 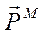 .
.
В теории Бора, когда с позиции классической теории рассматривается круговое движение электрона по орбите радиуса  со скоростью
со скоростью  , величина орбитального механического момента равна
, величина орбитального механического момента равна 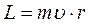 . Если время полного оборота электрона Т, то такому движению соответствует замкнутый ток
. Если время полного оборота электрона Т, то такому движению соответствует замкнутый ток
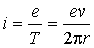 ,
,
который можно охарактеризовать величиной магнитного момента
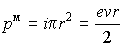 .
.
Связь механического и магнитного моментов при этом определяется гиромагнитным отношением
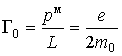
Так как заряд электрона отрицателен, то для орбитального движения направление вектора магнитного момента  противоположно направлению вектора механического момента импульса
противоположно направлению вектора механического момента импульса  (рис. 1).
(рис. 1).
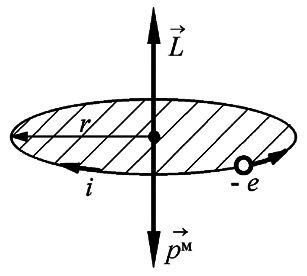
Рис.1.
Итак, в любом квантовом состоянии атом водорода обладает не только механическим моментом 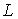 , но и магнитным моментом.
, но и магнитным моментом.
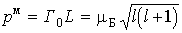
Здесь универсальная постоянная

служит единицей измерения магнитных моментов атомов и называется магнетоном Бора.
Если атом переходит из одного квантового состояния в другое с испусканием (поглощением) фотона излучения, то возможны лишь такие переходы, для которых орбитальное квантовое число 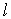 изменяется на единицу. Это правило, согласно которому для оптических переходов
изменяется на единицу. Это правило, согласно которому для оптических переходов  , называется правилом отбора. Наличие такого правила отбора обусловлено тем, что электромагнитное излучение (фотон) уносит или вносит не только квант энергии, но и вполне определенный момент импульса, изменяющий орбитальное квантовое число для электрона всегда на единицу.
, называется правилом отбора. Наличие такого правила отбора обусловлено тем, что электромагнитное излучение (фотон) уносит или вносит не только квант энергии, но и вполне определенный момент импульса, изменяющий орбитальное квантовое число для электрона всегда на единицу.
3. Магнитное квантовое число  . В квантовом состоянии с заданным значением орбитального квантового числа
. В квантовом состоянии с заданным значением орбитального квантового числа  , магнитное квантовое число может принимать
, магнитное квантовое число может принимать 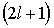 различных значений из ряда
различных значений из ряда
 .
.
Физический смысл магнитного квантового числа вытекает из того, что волновая функция 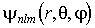 , описывающая квантовое состояние электрона в атоме водорода, является собственной функцией оператора проекции момента импульса
, описывающая квантовое состояние электрона в атоме водорода, является собственной функцией оператора проекции момента импульса  , причем
, причем
 .
.
Поэтому, из общих положений квантовой механики следует, что проекция момента импульса электрона на выделенное в пространстве направление  может иметь только определенные значения, равные
может иметь только определенные значения, равные
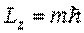
Направление  в пространстве обычно выделяется внешним полем (например, магнитным или электрическим), в котором находится атом.
в пространстве обычно выделяется внешним полем (например, магнитным или электрическим), в котором находится атом.
Так как формула квантования проекции механического момента соответствует вполне определенным направлениям ориентации в пространстве вектора  (рис. 2), то эту формулу называют обычно формулой пространственного квантования.
(рис. 2), то эту формулу называют обычно формулой пространственного квантования.
С точки зрения классического представления об электронной орбите, с учетом перпендикулярности вектора  к плоскости орбиты, соотношение
к плоскости орбиты, соотношение 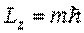 определяет возможные дискретные расположения электронных орбит в пространстве по отношению к направлению внешнего поля.
определяет возможные дискретные расположения электронных орбит в пространстве по отношению к направлению внешнего поля.
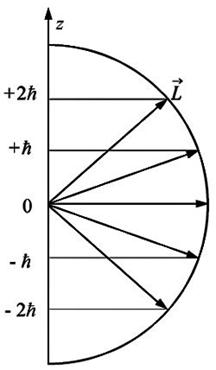
Рис.2.
Отмеченная выше связь механического и магнитного моментов атома позволяет с учетом 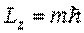 записать также возможные значения проекции магнитного момента атома на выделенное направление
записать также возможные значения проекции магнитного момента атома на выделенное направление  :
:

зависящие от значения магнитного квантового числа 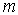 .
.
4. Спин электрона.
Из квантовой теории следует, что вследствие симметрии электронного "облака" механический и магнитный моменты атома, находящегося в основном, невозбужденном состоянии, равны нулю. Следовательно, если в опыте Штерна - Герлаха обеспечить условия, при которых в атомном пучке будут двигаться невозбужденные атомы, то такой атомный пучок не должен расщепляться магнитным полем. Поэтому на стеклянной пластинке мы увидели бы в центре одну узкую зеркальную полоску.
Однако, эксперимент не подтвердил такой вывод квантовой теории. Пучок невозбужденных атомов серебра расщепился на два пучка, которые напылили на стеклянной пластинке две узкие зеркальные полоски, сдвинутые симметрично вверх и вниз. Измерение этих сдвигов позволило определить магнитный момент невозбужденного атома серебра. Его проекция на направление магнитного поля оказалась равной 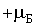 или
или  .
.
Это противоречие квантовой теории и опыта было не единственным, обнаруженным к этому времени в различных экспериментах. Все эти трудности квантовой теории были преодолены, когда в 1925 г. С.Гаудсмит и Дж.Уленбек выдвинули смелую теорию о том, что сам электрон является носителем "собственных" механического и магнитного моментов, не связанных с движением электрона в пространстве. Эта гипотеза получила название гипотезы о спине электрона.
Первоначально предполагалось, что спин обусловлен вращением электрона вокруг своей оси. Однако, такая модель вращающегося заряженного шарика оказалась несостоятельной. Прежде всего, расчет показал, что ни при каких допустимых (т.е. меньше скорости света) скоростях нельзя вращением электрона индуцировать магнитный момент, равный по величине магнетону Бора. Кроме того, величина гиромагнитного отношения собственного магнитного и механического моментов, рассчитанная для модели вращающегося электрона, оказалась в два раза меньше, чем получаемая в опытах.
Модель электрона, вращающегося вокруг своей оси, как вращается Земля, двигаясь по околосолнечной орбите, в настоящее время может использоваться только при популярном изложении свойств атома.
Спин электрона не имеет классического аналога. Он характеризует внутреннее свойство квантовой частицы, связанное с наличием у нее дополнительной степени свободы. Количественная характеристика этой степени свободы - спин 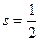 является для электрона такой же величиной как, например, его масса
является для электрона такой же величиной как, например, его масса  и заряд
и заряд  .
.
При согласовании теории и эксперимента Гаудсмит и Уленбек, по аналогии с орбитальными моментами, предположили, что величины собственных механического и магнитного моментов электрона определяются формулами
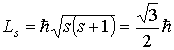
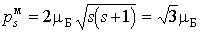
Проекции собственных моментов на выделенное направление  в такой теории определяются спиновым квантовым числом
в такой теории определяются спиновым квантовым числом 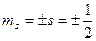 . При этом
. При этом
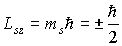
Величина спиновых моментов электрона постоянна, а с дополнительной степенью свободы электрона связаны  -проекции этих моментов, которые определяются спиновым квантовым числом
-проекции этих моментов, которые определяются спиновым квантовым числом 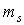 и принимают два значения. О таких двух квантовых состояниях обычно говорят как о состояниях со спином, направленным вверх
и принимают два значения. О таких двух квантовых состояниях обычно говорят как о состояниях со спином, направленным вверх 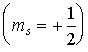 или вниз
или вниз  . Поэтому, определяя квантовое состояние электрона в любой системе следует указать также и ориентацию спина.
. Поэтому, определяя квантовое состояние электрона в любой системе следует указать также и ориентацию спина.
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 16387; Нарушение авторских прав?; Мы поможем в написании вашей работы!