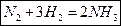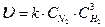КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Факторы, влияющие на скорость химических реакций
|
|
|
|
| Фактор | Характер влияния. | ||||||||||
| 1) Природа вещества. | Скорость реакции зависит от природы вещества – например, чем активнее металл, тем быстрее идёт его реакция с кислотой.
Теория столкновений.
Основная идея её такова: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией.
Выводы:
o Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
o К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Е а.
Минимальный избыток энергии, который должна иметь частица, чтобы произошло эффективное соударение, называется энергией активации (Еа)
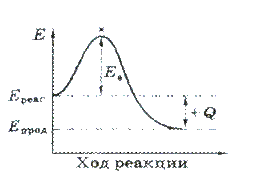 • Чем меньше Еа, тем больше скорость реакции
• Скорость реакции ионного обмена большая,
так как Еа велика
• Скорость реакции (N2 + H2) мала, так как
Еа велика
o Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в неорганических и органических веществах.
o Величина энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Задание на применение знаний:
o Объясните разную скорость взаимодействия цинка и магния с уксусной кислотой; цинка с соляной и уксусной кислотой.
o Напишите соответствующие реакции (в протоколе).
• Чем меньше Еа, тем больше скорость реакции
• Скорость реакции ионного обмена большая,
так как Еа велика
• Скорость реакции (N2 + H2) мала, так как
Еа велика
o Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в неорганических и органических веществах.
o Величина энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Задание на применение знаний:
o Объясните разную скорость взаимодействия цинка и магния с уксусной кислотой; цинка с соляной и уксусной кислотой.
o Напишите соответствующие реакции (в протоколе).
| ||||||||||
| 2) Концентрации реагирующих веществ. | В 1867г. норвежскими учеными К. Гульдбергом и П. Вааге был сформулирован основной закон химической кинетики:
n Закон действующих масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных коэффициентам в уравнении реакции.
Для реакции аА + вВ = сС + dD скорость равна:
v = k · c (A) a · c (B) b
где k – константа скорости, v = k при c (A) = c (B) = 1 моль/л
n - порядок реакции по веществу А,
m - порядок реакции по веществу В.
В простых (элементарных, одностадийных) реакциях – n и m численно равны коэффициентам в уравнении реакции при веществах А и В. n=a, m= в.
H2(г.) + I2 (г.) = 2HI (г.) v = k · c (H2) · c (I2)
2NO(г.) + O2 (г.) = 2NO2 (г.) v = k · c 2(NO) · c (O2)
|
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 789; Нарушение авторских прав?; Мы поможем в написании вашей работы!