
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов
|
|
|
|
Лекция 3. Равновесный потенциал электрода
В простейшем случае под термином электрод подразумевается металл, находящийся в электрическом контакте с электролитом. Электролит и металл отличаются типом проводимости.
Тип проводимости определяется типом носителей заряда, который переносится в электрическом поле. Проводимость металла - это электронная проводимость. Основными носителями заряда являются электроны. Проводимость в растворе электролита - ионная, поскольку основными носителями зарядов являются ионы. Ионный тип проводимости может осуществляться и в твердом теле, например в поверхностных пленках электродов различной природы. Электронной проводимости в растворах электролитов, как правило, не существует за исключением очень специальных случаев существования сольватированных электронов в растворах.
Иногда проводник с электронной проводимостью называется проводником первого рода, а с ионной - второго рода.
Ион по-гречески означает “странник” (предложено М. Фарадеем).
Электрод – это система последовательно включённых фаз, в которых одна (конечная фаза) представляет собой металл или полупроводник, а другая - электролит. Продукт электродной реакции называется избыточной фазой.
Материалы в соответствии с их проводимостью подразделяются на металлы, полупроводники и диэлектрики. К полупроводникам относятся вещества, величина электропроводности которых занимает промежуточное положение между электропроводностью металлов и изоляторов. На поверхности металла в контакте с электролитом могут находиться плёнки различной природы (солевые, оксидные и др.), в которых может осуществляться как электронная так ионная проводимость. Могут быть такие случаи, когда эти плёнки будут иметь полупроводниковую природу.
Избыточная фаза может быть жидкой, твёрдой и газообразной. Очень часто избыточной фазой бывают оксидные или солевые плёнки.
Zn  Zn +2 +2
Zn +2 +2 (3.а)
(3.а)
Cu ++ +2
 Cu (3.б)
Cu (3.б)
2H + +2
 H2
H2 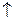 (3.в)
(3.в)
В реакции (3.а) избыточная фаза – растворенный цинк (Zn +2- жидкая фаза), в (3.б) – осажденная медь (Cu – твердая фаза), а в (3.в) – выделившейся газообразный водород (газообразная фаза).
Гальваническая ячейка (просто ячейка или элемент) – это электрическая цепь, состоящая из двух электродов, электролиты которых соприкасаются между собой так, что между электродами возникает проводящий контакт.
Схематическое обозначение гальванической ячейки может быть представлено таким образом, что границы фаз обозначаются вертикальными прямыми, а границы двух электролитов различных электродов – двойными. Например, элемент Даниеля может быть представлен следующим образом:
Cu | CuSO 4 (1М) || ZnSO 4 (1М) | Zn
Cu | CuSO 4 аq || ZnSO 4 аq | Zn
Концентрация раствора электролита может быть указана точно, а может только указываться состав растворителя.
Между металлом и электролитом, составляющими электрод, всегда возникает разность потенциалов. Она носит название напряжения электрода. Если это напряжение измерено по отношению к какому-то другому электроду, то такая разность потенциалов носит название – электродный потенциал.
Напряжение ячейки, элемента – это разность потенциалов между конечными металлическими фазами этой ячейки. Между разными металлами возникает контактная разность потенциалов.

Рис. 3.1 Гальваническая ячейка.

Рис. 3.2 Напряжение элемента (ячейки).
Напряжение ячейки аддитивно складывается из скачков потенциалов на различных фазах. Потенциал отдельного электрода может быть измерен только по отношению к какому-то электроду сравнения и соответственно характеризуется напряжением этой цепи. В качестве таких электродов используются стандартные электроды сравнения. Более подробно электроды сравнения буду рассмотрены ниже.
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 714; Нарушение авторских прав?; Мы поможем в написании вашей работы!