
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второй закон термодинамики. I. Первое начало термодинамики выражает всеобщий закон сохранения и превращения энергии
|
|
|
|
I. Первое начало термодинамики выражает всеобщий закон сохранения и превращения энергии.
Но первое начало не позволяет: 1) определить направление протекания процессов. Например: процесс самопроизвольной передачи энергии в форме теплоты от холодного тела к горячему не противоречий первому закону термодинамики, если только уменьшение внутренней энергии первого тела равно энергии, полученной вторым. Однако, при опускании раскаленного куска железа в холодную воду никогда не наблюдается явление дальнейшего нагревания железа за счет соответствующего охлаждения воды.
2) Первое начало термодинамики не исключает возможности такого процесса, единственным результатом которого было бы превращение теплоты полученной от некоторого тела, в эквивалентную ей работу. Так, например, основываясь на первом начале можно построить вечный двигатель 2-ого рода. Он будет совершать работу за счет охлаждения одного источника теплоты. Например, за счет внутренней энергии океанов. Обобщение огромного экспериментального материала привело к выводу о невозможности построения вечного двигателя 2-ого рода. Этот вывод получил название 2-ого закона термодинамики. Существует ряд различных по форме, но совершенно одинаковых по существу формулировок 2-ого начало.
Мы ограничимся только двумя.
А) Невозможен процесс, единственным результатом которого является превращение всей теплоты, полученной от нагревателя, в эквивалентную ей работу.
Б) Невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от холодного тела к горячему. Эти две различные по форме формулировки 2-ого закона полностью эквивалентны по содержанию.
II. Второй закон термодинамики указывает на необратимость процесса превращения работы в теплоту. Он утверждает, что процесс перехода упорядоченного движения тела как целого в неупорядоченное движение его частиц является необратимым. Упорядоченное движение может переходить в неупорядоченное без каких-либо дополнительных процессов это происходит, например, при внутреннем трении. Переход же неупорядоченного движения частиц в упорядоченное движение тел (перехода теплоты в работу) возможен лишь при условии, что он сопровождается каким-либо компенсирующим процессом. Так, например, при изотермическом расширении идеальный газ совершает работу, которая полностью эквивалентна теплоте, сообщаемой газу. Т. о., теплота целиком превращается в работу. Однако газ при этом расширяется, его объем возрастает. Поэтому газ не возвращается в исходное состояние и превращение теплоты в работу не является единственным результатом рассматриваемого процесса.
На основании 2-ого закона термодинамики можно показать, что К.П.Д. обратного цикла Карно не зависит от состава рабочего тела и всегда выражается формулой

Это положение называется теоремой Карно и служит основанием для установления термодинамической шкалы температуры
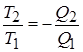 ;
; 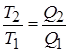
Можно также доказать, что К.П.Д. ηобр любого обратимого цикла не превосходит К.П.Д. цикла Карно ηк
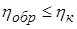
а К.П.Д. необратимого цикла Карно меньше К.П.Д. цикла Карно
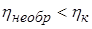
Ранее выведенное соотношение
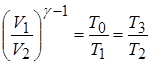

для А получим

Количество тепла, выделяемое при сгорании топлива

Тогда К.П.Д. реального газа равна

Наибольшая температура Т 2 и наименьшая Т 3 К.П.Д. из цикла Карно была
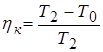 ,
,
т. к. 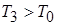 то
то 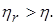
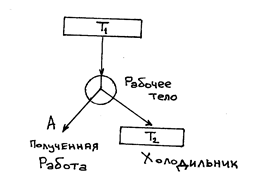 На рисунке представлена схема действия прямого цикла Карно позволяет провести его в обратном направлении по отношению рассмотренному.
На рисунке представлена схема действия прямого цикла Карно позволяет провести его в обратном направлении по отношению рассмотренному.
Такой обратимый цикл Карно является идеальной холодильной машиной. Действительно, при обратном цикле Карно внешние силы совершают над газом положительную работу А, равную А 1 совершенной при прямом цикле. При этом от холодильника будет получено тепло Q 2
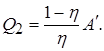
Нагреватель будет получать тепло 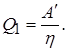 Схема действия холодильника показана на рисунке. Все изложенные результаты получены для цикла Карно с идеальным газом. Однако можно показать, что обратный цикл Карно, проводимый с любым рабочим веществом, имеет тот же самый К.П.Д., что и цикл Карно с идеальным газом.
Схема действия холодильника показана на рисунке. Все изложенные результаты получены для цикла Карно с идеальным газом. Однако можно показать, что обратный цикл Карно, проводимый с любым рабочим веществом, имеет тот же самый К.П.Д., что и цикл Карно с идеальным газом.
Лекция 14
Характеристика жидкого состояния
По своим свойствам жидкости схожи как с газами, так и с твердыми телами. Так, например, подобно газам, жидкости принимают форму того сосуда, в котором они находятся. С другой стороны, подобно твердым телам, жидкости мало сжимаемы, т.е. имеют определенный собственный объем. Они обладают сравнительно большой плотностью и также как и твердые тела способны сопротивляться не только сжатию, но и растяжению.
Двойственный характер свойств жидкости связан с особенностями движения их молекул. В газах их молекулы движутся совершенно хаотично, в их расположении отсутствует какой бы то ни было порядок. Наоборот, в кристаллических твердых телах частицы колеблются около определенных положений равновесия, называемых узлами кристаллической решетки.
Молекулы жидкости, подобно частицам твердого тела совершают колебания около положения равновесия, которые в отличие от положения равновесия в твердых телах имеют временный характер. Молекула колеблется около одного положения в течение некоторого времени τ. Затем положение ее равновесия смещается скачком на расстояние, равное по порядку величины среднему расстоянию δ между соседними молекулами.

n 0-число молекул в единице объема, ρ- плотность жидкости, μ – молекулярный вес.
Среднее время τ «оседлого» существования молекул жидкости зависит от температуры. С повышением температуры τ чрезвычайно быстро уменьшается, что обуславливает большую подвижность молекул жидкости при высоких температурах и малую вязкость. При низких температурах τ может достигать значительной величины. Для того, чтобы молекула жидкости перескочила из одного временного положения в другое, она должна нарушить связи с другими молекулами. После перехода в новое положение равновесия молекула связывается с новыми соседями. Первый процесс требует затраты энергии Е, которая выделяется при образовании новых связей. Следовательно, при уходе со старого места потенциальная энергия молекул должна возрасти на величину Е после чего молекула должна попасть в новое положение О также переходе говорят, как о переходе через потенциальный барьер высотой Е, а величину Е называют энергией активации.
Переход через потенциальный барьер происходит благодаря случайному повышению энергии теплового движения отдельных молекул за счет передачи им этой энергии другим молекулам. Расчеты показывают что время релаксации определяется формулой
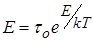
где τо – средний период колебаний молекул около положения равновесия.
Если время действия силы t>> τ, то частицы смещаются преимущественно в направлении этой силы и жидкость обнаруживает свойство текучести. Если t <<τ, то за время действия силы частица не успевает изменить свои положения равновесия и жидкость ведет себя как упругая среда, оказывающая сопротивление не только изменению объема, но и формы.
 В жидкостях средние расстояния между молекулами значительно меньше чем в газах. Поэтому силы взаимодействия между молекулами в жидкостях играют большую роль. Рассмотрим силы, действующие на молекулу у поверхности жидкости и внутри жидкости. Мысленно выделим в жидкости какую-либо молекулу r – радиус межмолекулярного взаимодействия. Если расстояние между молекулами велико, то силами межмолекулярного взаимодействия можно пренебречь. Внутри жидкости результирующая сила, действующая на молекулу равна нулю. У поверхности воды, сила молекулярного взаимодействия не компенсирована и направлена внутрь. На весь поверхностный слой действуют силы, направленные по нормали внутрь жидкости. Т. о., поверхностный слой оказывает на жидкость давление – называемое молекулярным давлением. Внутреннее давление в жидкостях достигает десятков тысяч атмосфер. Однако это давление невозможно измерить на опыте, т. к. оно не действует на стенки сосуда или тела погруженное в нее. Это объясняется тем, что оно всегда направленно внутрь жидкости нормально к ее поверхности. Если на жидкость не действуют внешние силы, то под действием молекулярного давления жидкость будет принимать форму минимальной поверхности, т. е. форму шара.
В жидкостях средние расстояния между молекулами значительно меньше чем в газах. Поэтому силы взаимодействия между молекулами в жидкостях играют большую роль. Рассмотрим силы, действующие на молекулу у поверхности жидкости и внутри жидкости. Мысленно выделим в жидкости какую-либо молекулу r – радиус межмолекулярного взаимодействия. Если расстояние между молекулами велико, то силами межмолекулярного взаимодействия можно пренебречь. Внутри жидкости результирующая сила, действующая на молекулу равна нулю. У поверхности воды, сила молекулярного взаимодействия не компенсирована и направлена внутрь. На весь поверхностный слой действуют силы, направленные по нормали внутрь жидкости. Т. о., поверхностный слой оказывает на жидкость давление – называемое молекулярным давлением. Внутреннее давление в жидкостях достигает десятков тысяч атмосфер. Однако это давление невозможно измерить на опыте, т. к. оно не действует на стенки сосуда или тела погруженное в нее. Это объясняется тем, что оно всегда направленно внутрь жидкости нормально к ее поверхности. Если на жидкость не действуют внешние силы, то под действием молекулярного давления жидкость будет принимать форму минимальной поверхности, т. е. форму шара.
|
|
|
Дата добавления: 2014-01-14; Просмотров: 427; Нарушение авторских прав?; Мы поможем в написании вашей работы!