
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциометрия
|
|
|
|
Основана на измерении электродвижущих сил (ЭДС) обратимых гальванических элементов, используется для определения содержания веществ в растворе и измерения различных физико–химических величин. В потенциометрии обычно применяют гальванический элемент, включающий два электрода. Электрод, потенциал которого зависит от концентрации определяемых ионов в растворе, называется индикаторным. Для измерения потенциала индикаторного электрода в раствор погружают второй электрод, потенциал которого не зависит от концентрации определяемых ионов. Такой электрод называется электродом сравнения. Величину ЭДС можно рассчитать по разности потенциалов этих электродов. Зависимость величины электродного потенциала (ЭП) от концентрации ионов в растворе выражается уравнением Нернста:
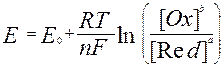
Электроды потенциометрии (БТ)
В потенциометрическом методе анализа используют два основных класса электродов:
– электроды, на межфазных границах которых протекают реакции с участием электронов, так называемые электронообменные (электроды первого, второго рода и окислительно-восстановительные);
– электроды, на межфазных границах которых протекают ионообменные реакции. Такие электроды называют мембранными, или ионообменными, их называют также ионоселективными.
Электроды I рода – электроды, находящиеся в равновесии с катионами, одноименными с металлом, и обратимые по отношению к ним. Простейший электронообменный электрод – металлическая пластинка, погруженная в раствор или расплав электролита
Zn/Zn2+; Cu/Cu2+ и т. д.
В качестве электрода сравнения используют стандартный водородный электрод (СВЭ) –
электрод I рода – Pt(H2)/2H+. Его потенциал определяется величиной pH и при комнатной температуре равен: E = E0 + 0,059lg[H+] = −0,059pH
Стандартный водородный электрод (СВЭ) неудобен в работе, его заменяют электродами II
рода – насыщенным каломельным электродом (н.к.э.) и хлорсеребряным (х.с.э.).
Электроды II рода – электроды, состоящие из металлической пластинки, покрытой малорастворимой солью этого металла, и обратимые по отношению к анионам соли.
| н.к.э. | х.с.э. | ||||
| Hg | Hg2 Cl2 | Cl- | Ag | AgCl | Cl- |
Концентрация Cl− поддерживается на определенном уровне путем добавления раствора хорошо растворимой соли с тем же анионом (чаще KCl)
Хлорсеребряный электрод (х.с.э.) – электрод, чувствительный к анионам Cl−, которые образуют осадки с катионами металла электрода (Ag+). Он представляет собой серебряную проволоку, покрытую равномерным слоем AgCl, который хорошо проводит электрический ток. Проволоку погружают в насыщенный раствор КСl. В растворе устанавливается равновесие: AgCl(тв) + e-→Ag(тв) + Cl−, т.е. его потенциал определяется концентрацией Cl− – ионов. Потенциал данного хлорсеребряного электрода равен +0,201 В. При концентрации КСl 0,1 н он равен +0,29 В, а при 1,0 н – -0,24 В.
Насыщенный каломельный электрод (н.к.э.) изготовлен на основе металлической ртути и каломели Hg2Cl2. Электрохимическое уравнение, характеризующее поведение электрода, описывается полуреакцией Hg2Cl2 + 2e-→2Hg + 2Cl−.
Так же, как и в случае х.с.э. потенциал зависит от концентрации Cl− – ионов. При использовании в качестве электролита насыщенного раствора КСl, потенциал электрода равен +0,244 В. Для 1 н раствора KCl E = 0,280 В; для 0,1 – -0,334 В.
Ионоселективные электроды – это электроды, обратимые по катионам или анионам, сорбируемыми твердой или жидкой мембраной. Они делятся на группы:
– стеклянные электроды;
– твердые электроды с гомогенной или гетерогенной мембраной;
– жидкостные электроды (на основе ионных ассоциативов, хелатов металлов или нейтральных лигандов);
– газовые электроды;
– электроды для измерения активности (концентрации) биологических веществ.
Мембранные электроды имеют форму пластинок из ионообменного материала, контактирующих с двумя растворами электролита МХ1(с1)/мембрана/ МХ2(с2).
Среди ионоселективных электродов наибольшее применение получил стеклянный электрод, предназначенный для измерения рН. Стеклянный электрод – это несколько условное название несложной системы, включающей небольшой сосуд из изолирующего стекла, к нижней части которого припаян шарик из специального электродного стекла. Такой электрод снабжен токоотводом. В качестве внутреннего стандартного раствора в стеклянном электроде используют 0,1 М раствор хлористоводородной кислоты обычно с добавкой хлорида натрия и калия. Можно использовать также какой-либо буферный раствор с добавкой хлоридов или бромидов. Токоотводом служит хлорсеребряный электрод, представляющий собой серебряную проволоку, покрытую хлоридом серебра. К токоотводу припаивают изолированный, экранированный провод. Стеклянный электрод обычно используют в паре с хлорсеребряным электродом сравнения. Применяемую при этом электрохимическую цепь можно записать следующим образом:
| Стеклянный электрод | Хлор-серебряный электрод | ||||
| Ag, AgCl | HCl(0,1M) | стекло | исследуемый раствор | KClнас | AgCl, Ag |
Потенциал стеклянного электрода обусловлен обменом ионов щелочных металлов, находящихся в стекле с ионами водорода из раствора. Энергетическое состояние ионов в стекле и растворе различно. Это приводит к тому, что ионы водорода так распределяются между стеклом и раствором, что поверхности этих фаз приобретают противоположные заряды между стеклом и раствором возникает разность потенциалов, значение которой зависит от рН раствора.
(В лабораторной практике стеклянные электроды применяют, как правило, для измерения рН. Перед началом работы стеклянные электроды следует выдержать некоторое время в 0,1 М растворе НСl. Ни в коем случае нельзя вытирать стеклянный шарик, так как это может разрушить гелиевую поверхность электрода. Категорически запрещается царапать поверхность электрода острыми предметами, так как толщина стеклянного шарика составляет десятые доли миллиметра и это выведет из строя чувствительный элемент)
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 1803; Нарушение авторских прав?; Мы поможем в написании вашей работы!