
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Излучение и поглощение энергии атомами и молекулами
|
|
|
|
В 1913 году Бором предложена теория излучения света, которая основывается на двух постулатах.
1. Внутренняя энергия атома дискретна, то есть может принимать только определённые дозволенные значения или уровни, кратные характерным для данного атома количествам, или квантам энергии. Состояния атома, соответствующие этим уровням энергии, являются стационарными: в таком состоянии атом не излучает электромагнитных волн, несмотря на происходящее в нём движение электронов.
2. Испускание (или поглощение) электромагнитного излучения происходит при переходе атома из одного стационарного состояния в другое. При этом испускается (или поглощается) фотон монохроматического излучения с энергией, равной разности энергетических уровней Еm и En, соответствующих этим состояниям:
hn = Em - En,
где Em и En - энергия системы в первом и втором состояниях.
На основе этих постулатов Бор разработал теорию излучения и поглощения энергии света атомом водорода. Он предположил, что из всех возможных орбит электрона осуществляются только те, для которых момент импульса (момент количества движений) равен целому кратному постоянной Планка, делённой на 2p:
 (n = 1, 2, 3,...). (1.)
(n = 1, 2, 3,...). (1.)
Число n, называется главным квантовым числом, соответствует порядковому номеру орбиты.
В случае атома водорода кулоновская сила взаимного притяжения протона и электрона является центростремительной силой, удерживающей электрон на орбите, то есть:
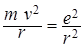 , (2)
, (2)
где m и е - масса и заряд электрона, r - радиус орбиты.
Исключая v из (1) и (2), получим, что радиус электронных орбит в атоме может принимать лишь ряд дискретных значений:
из (1)  подставляем в (2)
подставляем в (2)  откуда
откуда 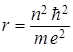 ,
,
(n = 1, 2, 3,...).
Таким образом, радиусы орбит стационарных атома водорода прямо пропорциональны квадрату квантового числа n2.
Для первой, основной, орбиты n = 1 и радиус 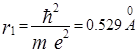 , то есть величина порядка газокинетических размеров атома.
, то есть величина порядка газокинетических размеров атома.
Из рассмотренных соотношений находится и скорость движения электрона по стационарной орбите 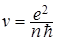 . Для основной орбиты атома водорода (n = 1):
. Для основной орбиты атома водорода (n = 1):  2,3 × 108 см/сек. Таков порядок скорости движения электронов по орбите.
2,3 × 108 см/сек. Таков порядок скорости движения электронов по орбите.
Энергетический уровень атома обусловлен полной энергией электрона, которая слагается из кинетической энергии электрона (ядро неподвижно) и энергии взаимодействия электрона с ядром (потенциальной энергии). Потенциальная энергия электрона (по знаку она отрицательна как потенциальная энергия сил притяжения):

Полная внутренняя энергия:
ЕЭ = 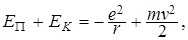
учитывая, что  ,
,
находим: ЕЭ = 
Таким образом, энергия электрона, связанного в атоме с ядром, отрицательна. Энергия же свободного электрона равна нулю.
Подставляя в это выражение значения скорости электрона, находим:
ЕЭ= (3)
(3)
Для атома водорода получаются следующие значения:
основной (нулевой) уровень, n = 1, Е1 = - 13,55 эВ;
n = 2, Е2 = - 3,38 эВ;
n = 3, Е3 = - 1,5 эВ.
Схема энергетических уровней атома водорода представлена на рисунке.
 | |||
| |||
Рис. 1. Структура энергетических уровней атома водорода.
Поскольку энергетические уровни обратно пропорциональны квадрату квантового числа n2, разность между каждыми двумя соседними уровнями по мере возрастания числа и по абсолютной величине уменьшается. Таким образом, по мере удаления от ядра разность между двумя соседними энергетическими уровнями атома убывает:
E2 - E1 > E3 - E2 > E4 - E3 ,...
Стационарный уровень с наименьшей энергией называется основным, он соответствует состоянию атома, не подвергающегося никаким внешним воздействиям. Остальные стационарные уровни называются возбуждёнными.
Возбуждение атома, то есть переход электрона на орбиту большего радиуса (Рис. 1., путь 1), требует сообщения атому дополнительной энергии и, следовательно, происходит в результате каких-либо внешних воздействий, например, при соударении частиц в процессе интенсивного теплового движения или при электрическом разряде в газах, при поглощении фотона электромагнитного излучения, в результате рекомбинации ионов в газе или электронов и дырок в полупроводнике, при действии на атом частиц радиоактивного излучения и т.д.
Возбужденное состояние неустойчиво, примерно через 10-8 сек электрон возвращается на основную орбиту, при этом излучается фотон, уносящий дополнительную энергию, полученную при возбуждении, и атом переходит в основное состояние (Рис.1., путь 2).
Электрон может возвращаться на основную орбиту не только единым переходом, но и ступеньками через промежуточные уровни. В этом случае при переходе будет излучаться несколько фотонов (Рис. 1., путь 3) с частотами, соответствующими разности энергий этих уровней.
Зависимость величины излучаемой атомами или молекулами энергии от длины волны или частоты световой волны называется спектром испускания, а поглощаемой - спектром поглощения. Интенсивность спектральных линий определяется числом одинаковых переходов, происходящих в единицу времени, и поэтому зависит от количества излучающих (поглощающих) атомов и вероятности соответствующего перехода.
Атомными спектрами называют как спектры испускания, так и спектры поглощения, которые возникают при квантовых переходах между уровнями свободных или слабо взаимодействующих атомов. Атомные спектры линейчаты.
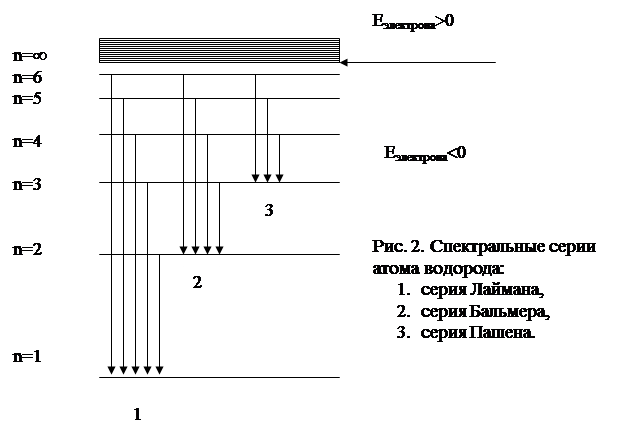
Под оптическими атомными спектрами понимают те, которые обусловлены переходами между уровнями внешних электронов с энергией фотонов порядка нескольких электрон-вольт. Сюда относятся УФ, видимая и близкая ИК (до мкм) области спектра. В спектре излучения атома водорода можно выделить несколько серий. Каждая серия соответствует переходам с различных уровней на один и тот же конечный.
Спектральные линии (частоты) этих серий можно рассчитать по формуле:
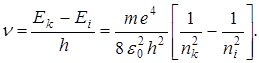 (4.)
(4.)
Серия Лаймена расположена в ультрафиолетовой области и образуется при переходах электронов с верхних энергетических уровней (ni=2, 3, 4…) на нулевой уровень (n=1).
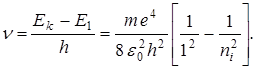 (5.)
(5.)
Серия Бальмера расположена в видимой и близкой ультрафиолетовой областях, а серия Пашена – в инфракрасной области.
Структура энергетических уровней сложных атомов усложняется расщеплением электронных уровней, зависящим от взаимодействия электронов между собой и ядром. Спектры подобных атомов полосатые.
Вопрос 2. 5 минут
Основные понятия квантовой теории.
В современной квантовой теории положение электрона в атоме не связывают с какой-либо орбитой, т. е. не устанавливают точного положения электронов в объеме атома, а рассматривают вероятность нахождения электрона в том или ином месте объема. Заряд электрона распределен по всему объему атома, образуя электронное облако переменной плотности. Плотность электронного облака в любой точке объема атома соответствует вероятности нахождения электрона в этой точке.
В квантовой механике состояние движения электронов в атоме характеризуется не одним, а четырьмя квантовыми числами:
1. Главное квантовое число n принимает только целочисленные значения от 1 до бесконечности.
2. Побочное (или орбитальное) квантовое число l принимает значения от 0 до (n-1) (всего n значений).
3. Магнитное квантовое число ml принимает целочисленные значения от –l до +l, включая 0 (всего (2l+1) значений).
4. Спиновое квантовое число ms может иметь только два полуцелых значения: + ½ и –½.
Квантовые числа определяют возможные энергетические состояния электронов в атоме. Каждый электрон характеризуется определенным набором квантовых чисел. Совокупность электронов, характеризующихся одним главным квантовым числом образуют энергетический уровень атома. Распределение электронов в атоме по энергетическим уровням осуществляется на основе принципов:
1. Принцип Паули: В атоме не может быть электронов, характеризующихся одинаковым набором квантовых чисел.
2. Принцип минимума энергии: Распределение электронов в атоме соответствует минимуму энергии атома.
Вопрос 3. 23 минут.
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 1610; Нарушение авторских прав?; Мы поможем в написании вашей работы!