
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Плотность газа рг рассчитывается по формуле
|
|
|
|
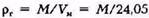 где
где — объем 1 моля газа при стандартных условиях.
— объем 1 моля газа при стандартных условиях.
Обычно значение рг находится в пределах 0,73— 1,0 кг/м3.
Чаще пользуются относительной плотностью газа по воздуху ргв, равной отношению плотности газа рг к плотности воздуха ρв, взятой при тех же давлении и температуре:
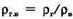 Если
Если и
и определяются при стандартных условиях, то
определяются при стандартных условиях, то = 1,293 кг/м3 и
= 1,293 кг/м3 и  =
= 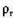 /1,293 кг/м3.
/1,293 кг/м3.
Уравнения состояния газов используются для определения многих физических свойств природных газов. Уравнением состояния называется аналитическая зависимость между давлением, объемом и температурой.
Состояние газов в условиях высоких давления и температуры определяется уравнением Клайперона — Менделеева; pV - NRT. где р — давление; V — объем идеального газа; N — число киломолей газа; R — универсальная газовая постоянная; Т — температура.
Эти уравнения применимы для идеальных газов.
Идеальным называется газ, силами взаимодействия между молекулами которого пренебрегают. Реальные углеводородные газы не подчиняются законам идеальных газов. Поэтому уравнение Клайперона - Менделеева для реальных газов записывается в виде
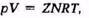 где Z - коэффициент сверхсжимаемости реальных газов, зависящий от давления, температуры и состава газа и харак теризующий степень отклонения реального газа от закона для идеальных газов.
где Z - коэффициент сверхсжимаемости реальных газов, зависящий от давления, температуры и состава газа и харак теризующий степень отклонения реального газа от закона для идеальных газов.
Коэффициент сверхсжимаемости Z реальных газов — это отношение объемов равного числа молей реального V иидеального Vи газов при одинаковых термобарических условиях (т.е. при одинаковых давлении и температуре): Z= V/ Vи
Значения коэффициентов сверхсжимаемости наиболее надежно могут быть определены на основе лабораторных исследований пластовых проб газов. При отсутствии таких исследований прибегают к расчетному методу оценки Z пo графику Г. Брауна (см. практическую работу). Для пользования графиком необходимо знать так называемые приведенные псевдокритическое давление и псевдокритическую температуру.
С приближением значений давления и температуры к критическим свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает и плотности их уравниваются.
С появлением в системе двух и более компонентов в закономерностях фазовых изменений возникают особенности, отличающие их поведение от поведения однокомпонентного газа. Не останавливаясь на подробностях, следует отметить, что критическая температура смеси находится между критическими температурами компонентов, а критическое давление смеси всегда выше, чем критическое давление любого компонента.
Для определения коэффициента сверхсжимаемости Z реальных газов, представляющих собой многокомпонентную смесь, находят средние из значений критических давлений и температур каждого компонента. Эти средние называются псевдокритическим давлением Pпкр и псевдокритической температурой Тпкр. Они определяются из соотношений:
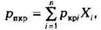
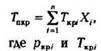 — критические давление и температура i;-го компонентахj — доля
— критические давление и температура i;-го компонентахj — доля  -го компонента в объеме смеси (в долях единицы).
-го компонента в объеме смеси (в долях единицы).
Приведенные псевдокритические давление и температура, необходимые для пользования графиком Брауна, представляют собой псевдокритические значения, приведенные к конкретным давлению и температуре (к пластовым, стандартным или каким-либо другим условиям): Рпр = Р / Рпкр Tпр = Т / Тпкр где р и Т — конкретные давление и температура, для которых определяется Z.
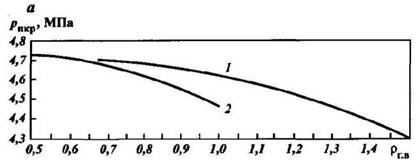
Если состав газа неизвестен, то его псевдокритические давление и температуру определяют по графикам (рис. 40). В том случае, когда в газе содержатся H2S, N2 и СО2, в значения, снятые с этих графиков, вводят поправки с соответствующим знаком. Если неуглеводородных компонентов в газе более 15%, графиками на рис. 40 пользоваться не рекомендуется
Рнс. 39. Диаграмма фазового состояния чистого этана (по Ш.К. Гиматудинову):

|
u— удельный объем; P -давление
Для определения коэффициента сверхсжимаемости Z реальных газов, представляющих собой многокомпонентную смесь, находят средние из значений критических давлений и температур каждого компонента. Эти средние называются псевдокритическим давлением Pпкр и псевдокритической температурой Тпкр. Они определяются из соотношений:
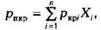
 — критические давление и температура i;-го компонентахj — доля
— критические давление и температура i;-го компонентахj — доля  -го компонента в объеме смеси (в долях единицы).
-го компонента в объеме смеси (в долях единицы).
Приведенные псевдокритические давление и температура, необходимые для пользования графиком Брауна, представляют собой псевдокритические значения, приведенные к конкретным давлению и температуре (к пластовым, стандартным или каким-либо другим условиям):
Рпр = Р / Рпкр Tпр = Т / Тпкр
где р и Т — конкретные давление и температура, для которых определяется Z.
Если состав газа неизвестен, то его псевдокритические давление и температуру определяют по графикам (рис. 40). В том случае, когда в газе содержатся H2S, N2 и СО2, в значения, снятые с этих графиков, вводят поправки с соответствующим знаком. Если неуглеводородных компонентов в газе более 15%, графиками на рис. 40 пользоваться не рекомендуется
Коэффициент сверхсжимаемости Z обязательно используется при подсчете запасов газа, прогнозировании изменения давления в газовой залежи и решении других задач.
Влагосодержание природных газов связано с тем, что природные газы и газоконденсатные смеси контактируют с пластовыми водами различных форм и видов (см. раздел 4 настоящей главы), вследствие чего содержат определенное количество паров воды. Концентрация водяных паров в газе зависит от его состава, давления, температуры. Отношение количества водяных паров (в долях единицы или процентах), находящихся в газе, к максимально возможному содержанию водяных паров в том же газе при тех же условиях называют относительной влажностью газа. Она характеризует степень насыщения газа водяным паром. Количество водяных паров, находящихся в единице объема или массы газа (г/м3 или г/кг), называют абсолютной влажностью.
Пары воды, присутствующие в газах и газоконденсатных смесях, влияют на фазовые превращения углеводородных систем. При определенных термодинамических условиях вода может выделяться из газа (конденсироваться), т.е. переходить в капельно-жидкое состояние. В газоконденсатных системах могут одновременно выделяться вода и конденсат. В присутствии воды давление начала конденсации УВ увеличивается
Объемный коэффициент пластового газа bг, представляющий собой отношение объема газа в пластовых условиях Vпл.г к объему того же количества газа Vст, который он занимает в стандартных условиях, можно найти с помощью уравнения Клайперона - Менделеева:
bг = Vпл.г / Vст = Z(РстТпл) / (РплТст ) (V. 15)
где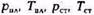 — давление и температура соответственно в пластовых и стандартных условиях.
— давление и температура соответственно в пластовых и стандартных условиях.
Значение величины bг имеет большое значение, так как объем газа в пластовых условиях на два порядка (примерно в 100 раз) меньше, чем в стандартных условиях.
|

 Рис. 40. Графики зависимости псевдокритических давления Рпкр (а) и температуры Тпкр (б) от плотности углеводородных газов по воздуху rг.в. по Ю.П. Гаттенбергеру).
Рис. 40. Графики зависимости псевдокритических давления Рпкр (а) и температуры Тпкр (б) от плотности углеводородных газов по воздуху rг.в. по Ю.П. Гаттенбергеру).
Месторождения: 1 — газовые, 2 — газоконденсатные; поправки, %, к величинам псевдокритических давления DР и температуры D
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 3102; Нарушение авторских прав?; Мы поможем в написании вашей работы!