
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Новые препараты инсулина
|
|
|
|
Препараты инсулина ультракороткого действия.
Лизпроинсулин (Lysproinsuline, Humalog). Традиционный инсулин образует в растворе и подкожной клетчатке гексамерные комплексы, которые несколько замедляют его всасывание в кровь. В лизпроинсулине изменена последовательность аминокислот в положениях 28 и 29 В-цепи с -про-лиз- на -лиз-про-. Это изменение не затрагивает активный центр инсулина, который взаимодействует с рецептором, но в 300 раз снижает его способность формировать гексамера и димеры.
Действие инсулина лизпро начинается уже через 12-15 мин, а максимум эффекта приходится на 1-2 часа, с общей продолжительностью действия 3-4 ч. Такая кинетика эффекта приводит к более физиологическому контролю постпрандиальной гликемии и реже вызывает гипогликемические состояния между приемами пищи.
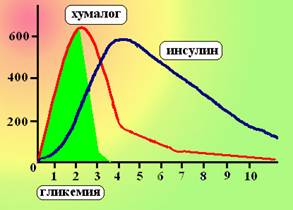
Схема 6. Фармакокинетические профили лизпроинсулина и обычного инсулина. Кривая лизпроинсулина (хумалога) в большей степени соответствует кривой гликемии после еды (зеленая зона) чем кривая обычного инсулина.
Лизпроинсулин следует вводить непосредственно перед едой или сразу после нее. Это осбенно удобно у детей, т.к. введение обычного инсулина требует, чтобы человек съел строго отмеренное число калорий, но аппетит ребенка во многом зависит от его настроения, капризов и родители не всегда могут убедить его в необходимости съесть должное количество пищи. Лизпроинсулин можно ввести после еды, рассчитав количество калорий, которые получил ребенок.
ФВ: флаконы по 10 мл (40 и 100 ЕД/мл), картриджи по 1,5 и 3 мл (100 ЕД/мл).
Аспартинсулин (insuline aspart, NovoRapide). Также является модифицированным инсулином ультракороткого действия. Получен путем замещения остатка пролина на аспарагиновую кислоту в положении 28 В-цепи. Его вводят непосредственно перед приемом пищи, при этом удается добиться более выраженного снижения постпрандиальной гликемии, чем при введении обычного инсулина.
ФВ: картриджи по 1,5 и 3 мл (100 ЕД/мл)
Препараты инсулина, лишенные пика действия.
Гларгининсулин (Glargineinsuline). Инсулин с тремя замещениями в полипептидной цепи: глицин в положении 21 А-цепи и добавочные остатки аргинина в положении 31 и 32 В-цепи. Такое замещение приводит к изменению изоэлектрической точки и растворимости инсулина. По сравнению с NPH инсулинами у гларгина кривая концентрации более плоская и пик действия плохо выражен.
Этот инсулин рекомендуется применять для моделирования базальной секреции инсулина у лиц с интенсифицированной схемой инсулинотерапии.
Препараты инсулина для энтерального применения.
В настоящее время разработаны препараты инсулина для перорального применения. Для защиты от разрушения протеолитическими ферментами инсулин в таких препаратах помещен в специальный аэрозоль (Oraline, Generex), который распыляют на слизистую оболочку рта или в гель (Ransuline), который принимают внутрь. Последний из препаратов разработан в Российской академии медицинских наук.
Главным недостатком этих препаратов на современном этапе является невозможность достаточно точного дозирования, т.к. скорость их абсорбции непостоянна. Однако, возможно что данные препараты найдут свое применение у лиц с инсулиннезависимым диабетом в фазу инсулинопотребности как альтернатива подкожному введению инсулина.
В последние годы появились сообщения, что концерн Merck & Co. исследует вещество, содержащиеся в грибке, паразитирующем на листьях некоторых из видов африканских растений. Как показывают предварительные данные это соединение можно рассматривать в качестве инсулиномиметика, активирующего инсулиновые рецепторы органов-мишеней.
ПЕРОРАЛЬНЫЕ САХАРОПОНИЖАЮЩИЕ СРЕДСТВА
Секретагоги. Секретагогами называют лекарственные средства, которые увеличивают выделение инсулина из b-клеток поджелудочной железы. К секретагогам относят 3 основные группы веществ (см. классификацию).
Производные сульфонилмочевины.
Эта группа лекарственные средств применяется в клинической практике с 1955 г. Открыта была совершенно случайно в 1942 г Janbon и сотр.
Механизм действия. В настоящее время полагают, что у всех производных сульфонилмочевины имеется 3 основных механизма действия:
1. Усиление секреции инсулина b-клетками поджелудочной железы. Производные сульфонилмочевины связываются со специфическими рецепторами, расположенными в калиевых каналах клеточной мембраны.
Калиевый канал представляет собой комплекс из 2 белков: канального белка KIR 6.2, который формирует ионный туннель в мембране клетки и рецепторного белка SUR, который имеет 2 субъединицы – наружную в 140 кДа и внутреннюю в 65 кДа (именно эта субъединица и содержит активный центр рецептора). В зависимости от строения SUR-белка различают 3 вида каналов:
· SUR-1 – каналы b-клеток поджелудочной железы, отвечают за секрецию инсулина.
· SUR-2A – каналы кардиомиоцитов, обеспечивают противоаритмическую и антиангинальную защиту миокарда.
· SUR-2B – каналы гладкомышечных клеток сосудов, обеспечивают их расширение.
Молекула производных сульфонилмочевины взаимодействует вначале с наружным белком SUR. Это приводит к растворению лекарства в мембране клетки и взаимодействию с активным центром белка 65 кДа. Занимая активный центр, производные сульфонилмочевины блокируют канал калия – они не позволяют ему открываться. Ток ионов калия из клетки прекращается и мембрана становится менее гиперполяризованной. Это способствует открытию каналов для ионов кальция и его поступлению в клетку. Увеличение внутриклеточной концентрации ионов кальция способствует секреции инсулина.
2. Снижение секреции глюкагона a-клетками поджелудочной железы. До конца этот механизм действия не изучен. Установлено, что секреция глюкагона снижается лишь при длительном применении пероральных сахаропонижающих средств.
3. Производные сульфонилмочевины увеличивают сродство рецепторов тканей-мишеней к инсулину, способствуют транслокации переносчиков глюкозы GLUT-4 в мембрану клетки, повышают активность ключевых ферментов липогенеза (глицерол-3-фосфоацил трансферазы) и гликогенеза (гликоген-синтетазы). При этом данный эффект производных сульфонилмочевины может составлять до 40-50% аналогичного эффекта инсулина.
Показания для назначения производных сульфонилмочевины: ИНСД при отсутствии эффекта от диетотерапии и режима физических нагрузок.
НЭ: Производным сульфонилмочевины в той или иной степени присущи следующие нежелательные эффекты:
1. Диспепсические явления – тошнота, рвота, диарея, боли в эпигастрии. Эти нежелательные эффекты можно ослабить при введении препарата во время еды.
2. Аллергические реакции, чаще всего в виде кожных поражений (сыпь, синдром Лайелла, Стивенса-Джонсона и др.).
3. Гематотоксические реакции (угнетение тромбопоэза и лейкопоэза), гемолиз эритроцитов, обострение порфирии. Чаще всего данная группа эффектов возникает при использовании карбутамида.
4. Гепатотоксические реакции – желтуха, обусловленная холестазом. Для профилактики данного эффекта необходимо не реже 1 раза в месяц контролировать у пациентов уровень билирубина и щелочной фосфатазы в крови.
5. Гипогликемическая кома. Развивается при превышении пациентом рекомендованной дозы лекарства или употреблениии лекарства, без последующего приема пищи. Для гипогликемии, вызванной пероральными сахаропонижающими средствами не характерна потливость. Гипогликемия носит рецидивирующий характер (повторно возникает в течение нескольких часов после купирования приступа), что связано с длительным действием производных сульфонилмочевины, особенно II поколения.
6. Тетурамоподобный эффект при приеме алкоголя. Возникает через 15-30 мин после употребления спиртного напитка. Проявляется тахикардией, головной болью, гиперимией лица и верхней половины туловища, повышением температуры кожи.
7. Привыкание (резистентность). Характеризуется снижением сахаропонижающего эффекта производных сульфонилмочевины через 4-5 лет их регулярного применения. Обусловлена истощением b-клеток поджелудочной железы, прогрессированием в них аутоиммунных поражений под влиянием производных сульфонилмочевины.
8. Блокада калиевых каналов миокарда. Данный эффект снижает устойчивость миокарда к гипоксии, оказывает проаритмическое действие. В 1970 г были опубликованы результаты исследования UGDP (Университетской группы по программе изучения диабета) в котором было показано, что терапия производными сульфонилмочевины в 2,5 раза повышает риск смерти от сердечно-сосудистых осложнений у таких больных. Однако, в 1998 г завершилось подведение итогов Британского проспективного исследования диабета (UKPDS), согласно которому производные сульфонилмочевины не повышают смертность от сердечно-сосудистых осложнений, но существенно и не снижают ее.
В настоящее время не имеется убедительных доказательств, что какое-либо из производных сульфонилмочевины имеет преимущества перед другими средствами этой группы. Однако, несмотря на общность механизма действия, показания для применения и нежелательные эффекты производные сульфонилмочевины имеют различные фармакокинетические характеристики и фармакологические эффекты.
Карбутамид (Carbutamide, Bucarbane) ФК: относительно быстро инактивируется в печени, время действия составляет 6-8 часов.
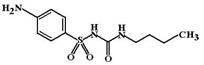 ФЭ: 1) увеличивает секрецию инсулина и его концентрацию в крови. При длительном применении секреция инсулина понижается, но на гипогликемизирующем эффекте это не сказывается; 2) сахаропонижающее действие – карбутамид понижает концентрацию глюкозы в крови; 3) слабый диуретический эффект.
ФЭ: 1) увеличивает секрецию инсулина и его концентрацию в крови. При длительном применении секреция инсулина понижается, но на гипогликемизирующем эффекте это не сказывается; 2) сахаропонижающее действие – карбутамид понижает концентрацию глюкозы в крови; 3) слабый диуретический эффект.
При использовании карбутамида достаточно часто возникали гематотоксические осложнения, поэтому его применение после 1998 г практически прекратилось.
РД: Принимают внутрь перед едой вначале по 1,0 г 2 раза в день, затем после улучшения состояния по 0,25-0,5 г 2 раза в день.
ФВ: таблетки по 0,5.
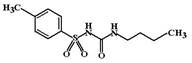 Толбутамид (Tolbutamide, Butamide) – является аналогом карбутамида, но значительно реже вызывает гематологические осложнения. Для него характерен определенный антидиуретический эффект, который связан со способностью толбутамида стимулировать вазопрессиновые рецепторы почек. При использовании толбутамида возможна задержка жидкости, развитие отеков, гипонатриемия.
Толбутамид (Tolbutamide, Butamide) – является аналогом карбутамида, но значительно реже вызывает гематологические осложнения. Для него характерен определенный антидиуретический эффект, который связан со способностью толбутамида стимулировать вазопрессиновые рецепторы почек. При использовании толбутамида возможна задержка жидкости, развитие отеков, гипонатриемия.
РД: лучше всего применять несколько раз в сутки (например, перед каждым основным приемом пищи и сном) по 500 мг. Суточная доза составляет 1,0-2,0 г.
ФВ: таблетки по 0,25 и 0,5.
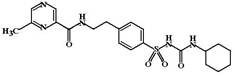 Глипизид (Glipiside, Minidiab, Glibinese). ФК: как и все средства II поколения глипизид на 98-99% связан с белками крови, поэтому одновременный прием других лекарственных средств, которые способны также интенсивно связываться с белками крови (фенитоин, НПВС, сульфаниламиды) может приводить к вытеснению глипизида из связи с белками, увеличению доли свободного лекарства и резкому усилению гипогликемизирующего эффекта. Глипизид хорошо всасывается из ЖКТ, инактивация его происходит в печени (при этом образуется до 4 неактивных метаболитов). Выведения осуществляется почками (90%) и слизистой ЖКТ (10%).
Глипизид (Glipiside, Minidiab, Glibinese). ФК: как и все средства II поколения глипизид на 98-99% связан с белками крови, поэтому одновременный прием других лекарственных средств, которые способны также интенсивно связываться с белками крови (фенитоин, НПВС, сульфаниламиды) может приводить к вытеснению глипизида из связи с белками, увеличению доли свободного лекарства и резкому усилению гипогликемизирующего эффекта. Глипизид хорошо всасывается из ЖКТ, инактивация его происходит в печени (при этом образуется до 4 неактивных метаболитов). Выведения осуществляется почками (90%) и слизистой ЖКТ (10%).
ФЭ: Помимо гипогликемизирующего и слабого диуретического действия глипизид обладает антиатерогенным эффектом – он улучшает липидный спектр крови, снижает уровни холестерина и триглицеридов в плазме крови, повышает уровень холестерина в ЛПВП.
РД: Вначале назначают внутрь по 2,5 мг 1 раз в день перед завтраком. В последующем дозу повышают на 2,5 мг в неделю до оптимальной (но не более 20 мг/сут), которую назначают в 2 приема.
ФВ: таблетки по 0,005 и 0,01.
 Гликвидон (Gliquidone, Glurenorm). ФК: В отличие от других производных сульфонилмочевины обладает печеночной элиминацией (»95% принятой дозы выводится с желчью). В связи с этим не требуется коррекция дозы у пациентов с заболеваниеями почек. Считают, что гликвидон наиболее показан пациентам с ИНСД и патологией почек (в том числе диабетической нефропатией).
Гликвидон (Gliquidone, Glurenorm). ФК: В отличие от других производных сульфонилмочевины обладает печеночной элиминацией (»95% принятой дозы выводится с желчью). В связи с этим не требуется коррекция дозы у пациентов с заболеваниеями почек. Считают, что гликвидон наиболее показан пациентам с ИНСД и патологией почек (в том числе диабетической нефропатией).
РД: Лечение начинают с 15 мг 1 раз в день утром, постепенно повышая дозу на 15 мг/сут добиваются оптимального эффекта. Максимально допустимая доза – 120 мг (4 таблетки в день).
ФВ: таблетки по 0,03
 Глибенкламид (Glibenclamide, Maninil). Относительно селективен к калиевым каналам поджелудочной железы: способность к связыванию SUR-1:SUR-2A = 6:1, поэтому он в меньшей степени влияет на миокард, чем другие средства.
Глибенкламид (Glibenclamide, Maninil). Относительно селективен к калиевым каналам поджелудочной железы: способность к связыванию SUR-1:SUR-2A = 6:1, поэтому он в меньшей степени влияет на миокард, чем другие средства.
РД: Прием начинают с 2,5-5,0 мг утром не позднее, чем за 1 час до завтрака. Максимально допустимая доза 15-20 мг/сут в 2 приема.
ФВ: таблетки по 1,75; 3,5 и 5 мг.
 Глимепирид (Glimepiride, Amaryl). В отличие от других средств более ранних поколений глимепирид растворяется в мембране клетки без участия 140 кДа субъединицы SUR-белка. Поэтому он способен непосредственно активировать 65 кДа субъединицу и длительно удерживаться вблизи нее постоянно то связываясь, то диссоциируя от рецепторного участка. Эффект глимепирида развивается быстро и сохраняется около 24 часов.
Глимепирид (Glimepiride, Amaryl). В отличие от других средств более ранних поколений глимепирид растворяется в мембране клетки без участия 140 кДа субъединицы SUR-белка. Поэтому он способен непосредственно активировать 65 кДа субъединицу и длительно удерживаться вблизи нее постоянно то связываясь, то диссоциируя от рецепторного участка. Эффект глимепирида развивается быстро и сохраняется около 24 часов.
Глимепирид отличается высокой избирательностью в отношении SUR-1 рецепторов. Селективность SUR-1:SUR-2A для него составляет 60:1, поэтому глимепирид практически не влияет на сердечно-сосудистую систему у больных ИНСД.
Глимепирид обладает рядом дополнительных эффектов:
· Активирует тирозинкиназу клеток жировой ткани. Эта тирозинкиназа необходима для фосфорилирования особого белка кавеолина, которые принимает участие в утилизации глюкозы жировой тканью.
· Обладает антиагрегационным эффектом. Глимепирид блокирует фермент ЦОГ и нарушает синтез тромбоксана А2 в тромбоцитах – мощнейшего стимулятора агрегации (склеивания) тромбоцитов. То есть глимепирид улучшает кровоток в мельчайших сосудах и капиллярах тканей.
РД: лечение начинают с приема 1-2 мг глимепирида 1 раз в день утром перед завтраком. В последующем, каждые 2-3 недели дозу увеличивают на 1 мг до оптимальной (как правило 4-6 мг/сут). Максимально допустимая доза – 8 мг 1 раз в день.
ФВ: таблетки по 0,001; 0,002; 0,003 и 0,004.
Таблица 9. Избирательность секретагогов в отношении SUR рецепторов.
| Лекарство | SUR-2A:SUR-1 |
| Толбутамид Глибенкламид Глимепирид Репаглинид Гликлазид | 1:1 1:6 1:60 1:300 1:16.000 |
Репаглинид (Repaglinide, NovoNorm). Является производным карбамоилметилбензойной кислоты.
 МД: Взаимодействует с аллостерическим центром SUR-1 единицы калиевого канала и резко повышает его чувствительность к уровню глюкозы в крови и АТФ в клетке. Повышение гликемии в крови после еды вызывает поступление глюкозы в b-клетки, образование АТФ, которая закрывает калиевые каналы и приводит к деполяризации мембраны с последующим выбросом инсулина.
МД: Взаимодействует с аллостерическим центром SUR-1 единицы калиевого канала и резко повышает его чувствительность к уровню глюкозы в крови и АТФ в клетке. Повышение гликемии в крови после еды вызывает поступление глюкозы в b-клетки, образование АТФ, которая закрывает калиевые каналы и приводит к деполяризации мембраны с последующим выбросом инсулина.
ФЭ: Репаглинид восстанавливает раннюю фазу постпрандиальной секреции инсулина, т.к. его действие проявляется только на фоне повышения уровня глюкозы в крови. По мере снижения гликемии эффект репаглинида ослабевает и при нормальном уровне глюкозы секреция инсулина вообще не изменяется.
В целом репаглинид в 3-5 раз сильнее стимулирует постпрандиальную секрецию инсулина по сравнению с производными сульфонилмочевины.
Репаглинид лишен основных недостатков, присущих производным сульфонилмочевины:
· У препаратов сульфонилмочевины пик секреции инсулина не синхронизирован с пиком постпрандиальной гликемии (это может служить причиной гипогликемических состояний). Действие репаглинида развивается быстро и полностью синхронизировано с пиком гликемии.
· Производные сульфонилмочевины стимулируют секрецию инсулина, но в то же время угнетают белоксинтезирующую функцию b-клеток (синтез инсулина). Репаглинид не оказывает никакого влияния на синтез инсулина, а лишь стимулирует его векрецию.
· Производные сульфонилмочевины по окончании своего действия подвергаются эндоцитозу внутрь b-клеток и могут вызывать модификацию ее белков с развитием аутоиммунных реакций (гибели b-клеток). Репаглинид по окончании своего действия диссоциирует от рецептора и удаляется с током крови.
· Производные сульфонилмочевины (за исключением гликлазида) имеют относительно низкую селективность в отношении SUR-1 белка b-клеток (SUR-1:SUR-2A = 6-60:1). Для репаглинида характерна высокая избирательность в отношении SUR-1 белка (индекс SUR-1:SUR-2A = 300:1).
ФК: Репаглинид быстро всасывается и также быстро метаболизируется (tmax и t½ составляют около 1 часа). Ни один из его метаболитов не является активным, а элиминация на 90% осуществляется печенью.
Показания к применению: 1) Нарушение толерантности к глюкозе; 2) ИНСД при невозможности коррекции гликемии диетой и физической нагрузкой.
Режим дозирования: Схема лечения репаглинидом является гибкой и отражена в виде простой и удобной для пациента концепции «Прием пищи – прием препарата, нет приема пищи – нет приема препарата». Таким образом, репаглинид назначают внутрь по 0,5-4,0 мг непосредственно перед основными приемами пищи.
НЭ: 1) гипогликемические состояния; 2) диспепсические явления; 3) гепатотоксичность (увеличение уровня трансаминаз и щелочной фосфатазы) при приеме в дозах свыше 16 мг/сут.
ФВ: таблетки по 0,0005; 0,001 и 0,002.
Периферические сенситайзеры – лекарственные средства, которые повышают чувствительность тканей-мишеней к инсулину, существенно не изменяя его уровень в крови.
Бигуаниды
В связи с частым развитием лактацидоза (возрастание уровня молочной кислоты в плазме, приводящее к развитию комы) после приема бигуанидов I поколения, в настоящее время для клинического применения разрешен только метформин.
Метформин (Metformine, Siofor). Механизм действия бигуанидов до конца не выяснен. Полагают, что в его реализации участвует несколько факторов:
1. Усиливается периферическая утилизация глюкозы тканями как в окислительных процессах (анаэробный гликолиз), так и неокислительных (синтез гликогена).
2. Замедляется абсорбция глюкозы из ЖКТ.
3. Угнетается глюконеогенез в печени в печени, за счет торможения активности ключевых ферметнов этого процесса – пируваткарбоксилазы и глюкозо-6-фосфатазы.
4. Повышается сродство рецепторов периферических тканей к инсулину.
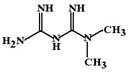 ФК: Метформин практически не связывается с белками крови, поэтому другие лекарства мало влияют на уровень свободной фракции лекарства. Он не подвергается метаболизму в печени и выводится почками в активной форме.
ФК: Метформин практически не связывается с белками крови, поэтому другие лекарства мало влияют на уровень свободной фракции лекарства. Он не подвергается метаболизму в печени и выводится почками в активной форме.
ФЭ:
· Для бигуанидов характерно эугликемическое действие – они снижают только повышенный уровень глюкозы, но не снижают гликемию у здоровых людей, а аткже после ночного голодания. Бигуниды эффективно ограничивают нарастание уровня гликемии после приема пищи. Кроме того, метформин оказывает на уровень глюкозы только нормализующее действие – он не снижает гликемию ниже нормальных значений и поэтому крайне редко приводит к возникновению гипогликемии.
· Бигуаниды не влияют на секрецию инсулина b-клетками поджелудочной железы.
· Анорексигенный эффект. Метформин снижает аппетит и позволяет пациенту легче переносить диетотерапию.
· Гиполипидемический эффект. Метформин снижает активность ГМГ-КоА-редуктазы – ключевого фермента синтеза холестерина, приводит к понижению в крови уровня триглицеридов, жирных кислот и ЛПНП, но практически не влияет на уровни других липопротеинов.
· Повышает фибринолитическую активность плазмы крови за счет торможения образования ингибитора активатора плазминогена PAI-1.
Показания для применения: 1) ИНСД средней тяжести у больных с тяжелым ожирением и гиперлипидемией, если диетотерапия не приносит должного эффекта; 2) резистентность к производным сульфонилмочевины; 3) метаболический синдром Х (сочетание ИНСД с гиперинсулинемией и инсулинорезистентностью, гиперлипидемией по триглицеридам, ЛПОНП, снижению холестерина ЛПВП и артериальной гипертензией).
Режим дозирования: принимают внутрь по 500 мг 3 раза в день или 850 мг 2 раза в день во время или после еды.
Согласно данным UKPDS метформин – единственное сахаропонижающее средство, для которого доказано, что он снижает смертность у пациентов с ИНСД.В связи с этим, а также в связи с эффективностью метформина при метаболическом синдроме Х бигуаниды переживают в настоящее время «второе рождение».
НЭ:
1. Диспепсические явления – наиболее часто встречается появление металлического вкуса во рту, болей в животе, диареи.
2. Развитие кетоацидоза и лактацидоза. Обусловлено интенсивным липолизом и активацией анаэробного гликолиза. Несмотря на то, что метформин вызывает эти осложнения достаточно редко (2,4 случая на 1млн. пациентов в год), они требуют оказания незамедлительной медицинской помощи. Предрасполагают к развитию лактацидоза резкое ограничение углеводов в диете, заболевания печени и почек, состояния сопровождающиеся развитием гипоксии в организме (сердечная и легочная недостаточность), употребление алкоголя.
3. В12-дефицитная анемия, связанная с нарушением всасывания витаминов В12 и Вс в кишечнике.
ФВ: таблетки по 0,5 и 0,85 в оболочке.
Тиазолидиндионы.
Это новая группа пероральных сахаропонижающих средств, действие которых связывают с влиянием на пероксисомные рецепторы. Выделяют 3 типа пероксисомных рецепторов: PPARa, PPARb, PPARg, которые относятся к семейству цитоплазматических рецепторов того же класса, что и рецепторы к витаминам А, D и тиреоидным гормонам. После взаимодействия рецептора со своим лигандом к образовавшемуся комплексу присоединяется коактиватор – рецептор RXR для ретиноевой кислоты и получившийся комплекс PPAR/RXR транслоцируется в ядро клетки, где активирует или репрессирует ряд генов. В таблице 10 представлена характеристика каждого из типов этих рецепторов.
 Пиоглитазон (Pioglitazone, Actos). Механизм действия: Пиоглитазон поступает в клетки жировой ткани, мышц и печени и активирует PPARg рецепторы, которые объединяются в комплекс с RXR рецептором ретиноевой кислоты и поступают в ядро клеток, где регулируют работу ряда генов, принимающих участие в контроле уровня гликемии и метаболизме липидов.
Пиоглитазон (Pioglitazone, Actos). Механизм действия: Пиоглитазон поступает в клетки жировой ткани, мышц и печени и активирует PPARg рецепторы, которые объединяются в комплекс с RXR рецептором ретиноевой кислоты и поступают в ядро клеток, где регулируют работу ряда генов, принимающих участие в контроле уровня гликемии и метаболизме липидов.
ФЭ:
· Повышается сродство инсулиновых рецепторов в клетках-мишенях к инсулину. Снижается инсулинорезистентность тканей (меньшие концентрации инсулина вызывают более мощный эффект).
· Улучшается липидный спектр крови: снижается уровень триглицеридов и возрастает уровень ЛПВП. На уровень общего холестерина и холестерина ЛПНП пиоглитазон практически не оказывает влияния.
· Замедляется развитие гипертрофии миокарда и стенки сосудов (основные факторы риска внезапной смерти) у больных артериальной гипертензией.
ФК: Пиоглитазон быстро всасывается после приема внутрь, пища незначительно замедляет скорость его абсорбции. В крови на 99% пиоглитазон связан с белками плазмы. Метаболизм пиоглитазона протекает в печени, при этом образуется 4 основных метаболита, три из которых фармакологически активны. Выведение пиоглитазона также осуществляется преимущественно печенью.
Показания: Лечение ИНСД при недостаточном контроле гликемии с помощью диеты и физической нагрузки. Применяют как в виде монотерапии, так и в дополнение к лечению производными сульфонилмочевины, метформином и инсулином.
Режим дозирования: Принимают внутрь по 30 мг/сут 1 раз в день независимо от времени приема пищи.
Таблица 10. Пероксисомные рецепторы клетки.
| Тип рецептора | Лиганд | Орган-мишень | Управляемые гены и эффект |
| PPARa | Жирные кислоты Фибраты | Жировая ткань Печень Иммунная система | Метаболизм жирных кислот Канцерогенез Противовоспалительное действие (” IL-6, “ IkB и инактивация NFkB) |
| PPARb | ??? | Жировая ткань Кожа | Метаболизм жирных кислот Канцерогенез |
| PPARg | PgJ2 Тиазолидиндионы | Жировая ткань Макрофаги Сердечно-сосудистая система | Дифференцировка адипоцитов, захват глюкозы Противовоспалительный эффект (” iNOS, IL-1,6 и ФНОa) Антитерогенное действие (” синтеза «скавенджер» рецепторов для окисленных ЛПНП, матричной металлопротеиназы) Снижение гипертрофии миокарда и стенки сосудов (” экспрессии с-Fos, нарушение миграции и пролиферации миоцитов). |
НЭ: Пиоглитазон может вызвать развитие гипогликемических состояний, особенно если его применяют в сочетании с другими сахаропонижающими средствами. Через 4-12 недель регулярного применения может развиваться незначительная анемия. В отличие от первого препарата группы тиазолидиндионов – троглитазона, пиоглитазон практически не оказывает гепатотоксического действия. Изредка возможны обратимые повышения уровня трансаминаз печени.
Пиоглитазон, как и другие тиазолидиндионы снижает эффективность пероральных контрацептивных средств, за счет снижения в крови концентрации эстрогенов и прогестинов, входящих в состав таблеток. Механизм этого эффекта остается неясным.
ФВ: таблетки по 0,015 и 0,03.
Средства, снижающие абсорбцию углеводов в кишечнике – лекарственные средства, которые уменьшают постпрандиальную гипергликемию у больных сахарным диабетом за счет нарушения абсорбции углеводов в кишечнике.
Ингибиторы a-глюкозидаз
Акарбоза (Acarbose, Glucobay). Представляет собой псевдотетрасахарид в котором молекула псевдосахарида связана с молекулой мальтозы. Получают путем ферментации из Actinoplanes utahensis.
МД: Всасывание углеводов в кишечнике происходит в форме моносахаридов. Акарбоза взаимодействует с активным центром гликолитических ферментов поджелудочной железы и  кишечника - a-глюкозидазы, мальтазы, сахаразы и обратимо блокирует их. При этом ферменты не могут расщеплять олиго- и дисахариды пищи до моносахаридов. Поскольку не образуются моносахариды всасывание углеводов значительно уменьшается.
кишечника - a-глюкозидазы, мальтазы, сахаразы и обратимо блокирует их. При этом ферменты не могут расщеплять олиго- и дисахариды пищи до моносахаридов. Поскольку не образуются моносахариды всасывание углеводов значительно уменьшается.
ФЭ: Акарбоза снижает гликемию обусловленную, главным образом, приемом пищи (постпрандиальную гликемию). По величине гипогликемизирующего действия эффект акарбозы составляет 30-50% эффекта производных сульфонилмочевины.
Поскольку на секрецию инсулина акарбоза не влияет, она не приводит к развитию гипогликемии.
ФК: Акарбоза практически не всасывается из ЖКТ (абсорбция составляет менее 2%). Всосавшаяся часть лекарства выделяется почками в неизмененном виде.
Применение:
· Акарбозу рассматривают как средство выбора у пациентов с ИНСД, если гликемию не удается контролировать диетой и физической нагрузкой.
· ИНСД и ИЗСД для снижения потребности в инсулине и пероральных сахаропонижающих средствах.
Режим дозирования: Лечение начинают с 25 мг 3 раза в день во время еды внутрь, дозу постепенно с интервалом в 1-2 месяца повышают до 300-600 мг/сут.
НЭ: Прекращение переваривания и всасывания углеводов приводит к тому, что они поступают в толстый кишечник, где бактериальной флорой разрушаются до жирных кислот, СО2 и Н2. Это вызывает возникновение диспепсических расстройств – чувства переполнения в животе, метеоризма, борборигмов (урчания), диареи.
ФВ: таблетки по 0,05 и 0,1.
ЛЕКАРСТВЕННЫЕ СРЕДСТВА, С АКТИВНОСТЬЮ ГЛЮКОКОРТИКОИДНЫХ И МИНЕРАЛОКОРТИКОИДНЫХ ГОРМОНОВ, ИНГИБИТОРЫ СИНТЕЗА СТЕРОИДНЫХ ГОРМОНОВ.
Врач прежде всего должен задать себе вопрос, насколько заболевание, при котором предполагается использовать кортикостероиды, более опасно для больного, чем развивающийся при лечении ими синдром Кушинга
Дж. М. Лиддл, 1961
Надпочечники – парные эндокринные органы, которые расположены у верхнего полюса почек. В надпочечниках различают корковое и мозговое вещество. Мозговое вещество вырабатывает адреналин, норадреналин и адреномедуллин – гормоны, которые контролируют уровень АД у человека.
Корковое вещество надпочечников вырабатывает гормоны стероидной структуры. Гормональные стероиды надпочечников можно разделить на 3 группы:
· Гормоны, которые контролируют межуточный обмен (глюкокортикостероидные гормоны) – основными являются кортизол и кортикостерон (гидрокортизон);
· Гормоны, контролирующие обмен натрия и калия (минералокортикоидные гормоны). Основным представителем этой группы является альдостерон;
· Гормоны, контролирующие репродуктивную функцию (половые стероиды) – прогестерон и дигидроэпиандростерон. Главным источником данной группы гормонов являются не надпочечники, а половые железы. У мужчин в яичках вырабатывается основной андроген – тестостерон, а у женщин в яичниках – эстрогены (эстрон, эстрадиол и эстриол) и гестагены (прогестерон).
ГЛЮКОКОРТИКОСТЕРОИДНЫЕ СРЕДСТВА
Синтез и секреция глюкокортикоидных гормонов. Синтез кортикостероидов находится под контролем гипофиза и гипоталамуса. Гипоталамус в пульсирующем режиме выделяет кортиколиберин, причем стимулами секреции являются прием пищи и начало светового дня. Под влиянием кортиколиберина гипоталамус образует АКТГ, который активирует рецепторы на поверхности клеток коры надпочечников. Под влиянием АКТГ активируются 3 ключевых протеина, принимающих участие в синтезе глюкокортикостероидов:
1. Холестерол-эстераза – фермент, освобождающий холестерин из эфиров внутриклеточных депо.
2. StAR-протеин – челнок, который переносит холестерин в митохондрии, где протекает первый этап синтеза стероидных гормонов (образование прегненолона).
3. P450SCC – фермент отщепляющий боковою цепь холестерина при синтезе прегненолона.
После образования прегненолона, синтез стероидных гормонов протекает по 3 относительно независимым путям (см. рис. 1):
· При помощи 17-a-гидроксилазы прегненолон превращается в 17-гидроксипрегненолон, из которого под влиянием 21b- и 11b-гидроксилаз образуются глюкокортикостероиды (кортизол). Это основной путь синтеза глюкортикостероидов.
· Часть 17-гидроксипрегненолона, которая образовалась на предыдущем этапе, подвергается повторному действию 17-a-гидроксилазы и превращается в основной андроген надпочечников – дигидроэпиандростерон. Это основной путь синтеза половых стероидов в надпочечниках. В половых железах дигидроэпиандростерон в дальнейшем подвергается действию 17-кеторедуктазы и образуется тестостерон. В яичках у мужчин синтез на этом этапе обрывается. У женщин при помощи фермента ароматазы, которая располагается в яичниках, жировой ткани, ткани молочной железы тестостерон превращается в эстрогены.
· Под влиянием 3b-гидрокси-D5D4-изомеразы прегненолон превращается в прогестерон. Который в последующем под воздействием 21b- и 11b-гидроксилаз превращается в альдостерон. Это основной путь синтеза минералокортикоидов. Часть альдостерона способна конвертироваться в слабый глюкокортикоид кортикостерон, поэтому это также дополнительный путь синтеза глюкортикоидов.
Глюкокортикоиды, которые надпочечники выбрасывают в кровь в виде 8-10 пиков (причем максимальные 2 пика приходятся на 5-8 часов утра) по механизму отрицательной обратной связи понижают синтез и секрецию кортиколиберина и АКТГ.
Классификация средств с активностью глюкокортикостероидных гормонов.
I. Средства, с активностью природных гормонов: гидрокортизон.
II. Синтетические глюкортикоидные средства: преднизолон, метилпреднизолон, дексаметазон, триамцинолон.
III. Синтетические глюкокортикоидные средства для местного применения: флюметазон, беклометазон, будесонид.
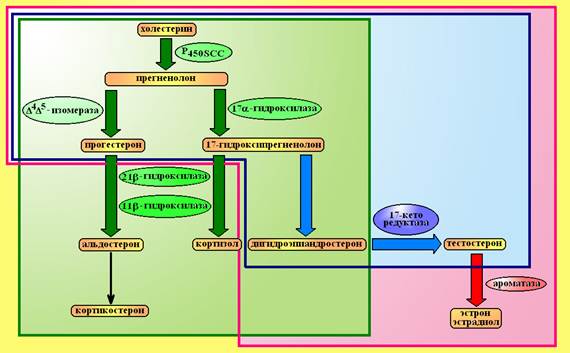
Рисунок 1. Схема биосинтеза стероидных гормонов. В надпочечниках биосинтез протекает по 3 путям: D5D4-изомеразный путь (синтез минералокортикоидов), 17a-гидроксилазный путь (синтез глюкокртикоидов), двойной 17a-гидроксилазный путь (синтез половых стероидов). В яичках имеется 17-кеторедуктазный этап синтеза тестостерона, а в яичниках - ароматазная конверсия андрогенов в эстрогены.
Механизм действия. Глюкокортикостероиды поступают к клеткам-мишеням и проникают через их мембрану в цитоплазму, где связываются со специфическими рецепторами. В покое глюкортикоидные рецепторы связаны с белком теплового шока (hsp90) в неактивный комплекс. Под влиянием глюкокортикоидного гормона рецептор освобождается от белка, присоединяет гормон, после чего комплексы гормон-рецептор объединяются попарно и полученные пары поступают в ядро клетки, где связываются с рецепторными последовательностями нуклеотидов на поверхности ДНК. В качестве такой рецепторной последовательности выступает палиндром GGTACAxxxTGTTCT. Активация рецепторов ДНК приводит к изменению процессов транскрипции ряда генов.
Физиологические эффекты глюкокортикоидных гормонов. Данная группа эффектов возникает даже при физиологической концентрации гормонов в организме.
1. Влияние на метаболизм углеводов. Глюкокортикоиды вызывают повышение концентрации глюкозы в крови несколькими путями:
· снижают захват глюкозы тканями за счет торможения работы глюкозных транспортеров GLUT-1 и GLUT-4;
· стимулируют процессы глюконеогенеза из аминокислот и глицерина (усиливают синтез ключевых ферментов глюконеогенеза – фосфоенолпируват карбоксикиназы, фруктозо-2,6-бифосфатазы, глюкозо-6-фосфатазы);
· стимулируют синтез гликогена за счет образования дополнительных молекул гликоген синтетазы.
2. Влияние на обмен липидов. Гипергликемия, которую вызывают глюкокортикостероиды, приводит к увеличению секреции инсулина и поэтому на жировую ткань влияет одновременно 2 гормона – глюкокортикоид и инсулин. Жировая ткань на конечностях более чувствительна к глюкокортикоидам, поэтому здесь кортикостероиды тормозят захват глюкозы и усиливают липолиз (распад жира). В итоге, содержание жира на конечностях уменьшается.
На туловище жировая ткань более чувствительна к действию инсулина и поэтому в ее клетках усиливается липогенез (синтез жира). В итоге, под влиянием глюкокортикостероидов происходит перераспределение жира в организме: у человека откладывается жир на груди, животе, ягодицах, лицо округляется, на тыльной поверхности шеи появляется «бычья холка». В то же время конечности у таких людей практически лишены жира.
3. Влияние на обмен аминокислот. Глюкокортикостероиды стимулируют синтез РНК и белка в печени, усиливают распад белков в тканях мышц, коже, соединительной, жировой и лимфоидной ткани (лимфоузлы, вилочковая железа, селезенка). Т.о. для глюкокортикоидов характерно катаболическое действие.
4. Минералокортикоидная активность. Глюкокортикостероидные гормоны способны активировать рецепторы для минералокортикоидов (хотя и в меньшей степени, чем минералокортикоидные гормоны). В результате, в собирательных канальцах нефрона активируются гены синтеза белка пермеазы, который формирует каналы для реабсорбции ионов натрия. В результате реабсорбции натрия в организме задерживается жидкость, увеличивается объем циркулирующей крови и возрастает секреция ионов калия в мочу.
Фармакологические эффекты глюкокортикоидов. Эта группа эффектов возникает только при супрафизиологических концентрациях гормона в организме.
1. Противовоспалительный эффект. Глюкокортикоиды подавляют все фазы как острого, так и хронического воспалительного процесса. Точный механизм противовоспалительного эффекта до настоящего времени не установлен. Полагают, что в его реализации играют роль несколько процессов:

Рисунок 2. Схема биосинтеза эйкозаноидов из арахидоновой кислоты. COX-I,II - циклооксигеназы I и II типов, 5-LOG – 5-липоксигеназа, Pg – простагландины, LT – лейкотриены, 5- и 12-HPETE – 5- и 12-гидропероксиэйкозатетраеновые кислоты, ГКС – глюкокортикостероиды, НПВС – нестероидные противовоспалительные средства. На схеме показаны рецепторы для простагландинов:
EP – расслабление гладких мышц, усиление секреции воды в кишечнике, торможение секреции HCl, натрийурез, снижение выделения АДГ, пирогенез.
DP – агрегация тромбоцитов.
FP – сокращение гладких мышц, усиление секреции воды в кишечнике, выделение ФСГ, ЛГ, пролактина, воспаление.
IP – расслабление гладких мышц, снижение агрегации тромбоцитов, натрийурез, снижение секреции ренина.
TP – сокращение гладких мышц и усиление агрегации тромбоцитов.
· В очаге воспаления повышается активность фосфолипазы А2 и циклооксигеназы-II (ЦОГ-II) типа, которые участвуют в синтезе медиаторов воспаления – простагландинов и лейкотриенов. Кортикостероиды тормозят гены, отвечающие за синтез ЦОГ-II. Кроме того, под влиянием глюкокортикоидов активируются гены, отвечающие за синтез особого белка – липокортина. Этот белок способен связывать фосфолипазу А2 в неактивные комплексы. Поэтому, при введении глюкокортикостероидов снижается активность фосфолипазы А2 и циклооксигеназы-II типа, уменьшается синтез провоспалительных цитокинов (см. рис. 2.).
· В очаге воспаления в большом количестве образуются молекулы клеточной адгезии – особые белки, которые синтезируются клетками эндотелия и необходимы для привлечения в очаг воспаления лейкоцитов и макрофагов. Глюкокортикостероиды снижают синтез молекул клеточной адгезии, миграция лейкоцитов и макрофагов в очаг воспаления прекращается.
· В очаге воспаления образуются митогенные факторы (ФНОa), которые стимулируют размножение фибробластов (основных клеток соединительной ткани) и процессы рубцевания воспаленной ткани. Данный процесс может быть весьма опасен, т.к. в процессе рубцевания в ткани могут погибнуть нормальные клетки (например, при ревматическом воспалении суставов процесс рубцевания приводит к разрушению хряща и кости сустава и прекращению движений в суставе). Глюкокортикоиды тормозят гены ФНОa и уменьшают процессы фиброзирования в очаге воспаления.
2. Иммунодепрессивный эффект. Глюкокортикостероиды оказывают многостороннее угнетающее действие на иммунную систему, связанное с подавлением ряда цитокинов:
| Воздействие на иммунную систему | Вызываемый эффект |
| Торможение генов синтеза: · IL-1, · IL-2, · IL-6, · IL-12 | Не происходит активации Т-хелперов Т-хелперы не передают сигнал на рабочие лимфоциты Не происходит созревания В-лимфоцитов в плазматические клетки для синтеза антител Не происходит созревания Т-лимфоцитов и ЕК-клеток, ослабляется эффект IL-2. |
| Апоптоз B-лимфоцитов | Угнетение гуморального иммунитета (нарушение синтеза антител), снижение сопротивляемости к бактериальным инфекциям. |
| Апоптоз Т-лимфоцитов, макрофагов и натуральных киллеров | Угнетение клеточного иммунитета: противовирусного иммунитета, аллергических реакций замедленного типа, реакции отторжения трансплантата. |
| Подавление синтеза g-интерферона | Нарушение противовирусного иммунитета. |
| Подавление продукции антигенов в поврежденных тканях | Снижение аутоиммунных процессов. |
| Торможение синтеза и увеличение распада компонентов системы комплимента | Нарушение процессов лизиса чужеродных клеток (не образуется мембраноатакующий комплекс) |
3. Влияние на сердечно-сосудистую систему. Глюкокортикоиды повышают артериальное давление и стабилизируют его на этом повышенном уровне. Эффект связывают с одной стороны с увеличением ОЦК на фоне задержки жидкости из-за минералокортикоидной активности, с другой стороны – с повышением чувствительности миокарда и сосудов к катехоламинам.
4. Влияние на кроветворение. Глюкокортикоиды тормозят синтез гемопоэтических факторов – IL-4 и гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), которые необходимы для процесса деления стволовых клеток костного мозга. Поэтому на фоне введения глюкокортикоидов в крови снижается уровень лимфоцитов, моноцитов, базофилов, эозинофилов. В то же время образование нейтрофилов в костном мозге и их концентрация в крови возрастает. После однократного введения глюкокортикоидов этот эффект достигает максимального значения к 6-му часу и уменьшается к концу суток.
5. Влияние на органы дыхания. В последний месяц беременности у плода глюкокортикоиды активируют гены, отвечающие за синтез сурфактанта – поверхностно-активного вещества, которое покрывает альвеолы легких и необходимо как для их раскрытия в момент первого вдоха, так и для защиты в последующем ткани легких от коллапса (спадения).
Применение глюкокортикоидов. Различают три вида глюкокортикоидной терапии.
1. Возмещающая терапия – проводится при хронической надпочечниковой недостаточности (болезнь Аддисона) и острой надпочечниковой недостаточности, например при шоке (синдром Уотерхауса-Фридрексена). Как правило для возмещающей терапии рекомендуется применять глюкокортикоиды с минералокортикоидной активностью.
2. Супрессорная (подавляющая) терапия. Применяется при следующих состояниях:
· Для подавления продукции андрогенов у девочек с адреногенитальным синдромом. При адреногенитальном синдроме имеется врожденный дефект фермента 21b-гидроксилазы, который обеспечивает последние этапы синтеза глюкокортикостероидов. Поэтому, в организме девочек с этим синдромом уровень глюкокортикоидов низкий и, по механизму отрицательной обратной связи, этот недостаток стимулирует клетки гипоталамо-гипофизарной зоны и уровень кортиколиберина и АКТГ повышается. Если бы активность фермента 21b-гидроксилазы была нормальной это вызвало бы усиление синтеза глюкокортикоидов, но в данном случае процесс синтеза останавливается на более раннем этапе – на уровне прогестерона и 17-гидроксипрегненолона, которые подвергаются конверсии в дигидроэпиандростерон по андрогенному пути (см. рис. 1). Т.о. в организме детей с адреногенитальным синдромом возникает избыток андрогенов. У девочек это проявляется вирилизацией (гирсутизм, мутация голоса по мужскому типу, мужское телосложение, гипертрофия клитора и недоразвитие матки). Назначение небольших доз глюкокортикоидов у таких пациентов приводит к тому, что по механизму обратной связи выделение АКТГ подавляется и избыточная продукция андрогенов надпочечниками прекращается.
· Для подавления реакции отторжения трансплантата у пациентов с пересаженными органами. Глюкокортикостероиды подавляют реакции клеточного иммунитета, которые вызваны антигенами чужеродного органа.
· Кортикостероиды входят практически во все современные схемы химиотерапии злокачественных опухолей крови, рака молочной железы. В данном случае их применение служит основой синхронизирующей терапии. Клетки опухолевой ткани находятся на разных стадиях созревания и деления и поэтому имеют различную чувствительность к химиопрепаратам. Применение глюкокортикостероидов останавливает развитие клетки в тот момент, когда она проходит фазу G2 жизненного цикла (предмитотическую). Поэтому при назначении глюкокортикоидов все клетки постепенно синхронизируются – застывают в фазе G2. Как только синхронизация достигается, глюкокортикостероиды отменяют, и все клетки опухоли одновременно вступают в митоз и приобретают высокую чувствительность к химиопрепаратам.
3. Фармакодинамическая (патогенетическая) терапия. Существует в двух формах:
· Интенсивная глюкокортикоидная терапия. Глюкокортикоиды вводят в высоких дозах (5 мг/кг в сутки по преднизолону) как правило внутримышечно или внутривенно. При отсутствии эффекта дозу каждые 4 часа увеличивают на 25-50%. После стабилизации состояния, через 1-2 дня лечение одномоментно прекращают. Данный вид терапии применяют при:
] анафилактическом шоке (стероиды обрывают аллергическую реакцию и стабилизируют АД);
] травматическом шоке (стероиды стабилизируют АД);
] астматическом статусе (состоянии, при котором приступы астмы следуют друг за другом без периодов улучшения);
] токсичесокм отеке легкого, вызванном удушающими веществами (в этом случае стероиды используют ингаляционно – в течение 15 минут пациенту необходимо проингалировать 200-400 стандартных доз стероида, т.е. 1-2 аэрозольных баллончика).
· Лимитирующая (долговременная) терапия. Проводится в течение нескольких месяцев, лет или даже пожизненно. В данном случае дозы кортистероидов подбирают индивидуально, но, как правило, они не превышают 5-10 мг/кг в день по преднизолону. Данная терапия ставит перед собой целью подавить хронический воспалительный или аутоиммунный процесс. Ее применяют при:
] болезнях соединительной ткани (системная красная волчанка, ревматоидный артрит, системная склеродермия, дерматомиозит, узелковый периартериит и др.);
] болезнях ЖКТ (неспецифический язвенный колит, болезнь Крона, гепатиты);
] болезнях дыхательных путей (бронхиальная астма тяжелого течения);
] болезнях почек (хронический гломерулонефрит, нефротический синдром);
] болезнях крови (тромбоцитопеническая пурпура или болезнь Верльгофа);
] аутоиммунных заболеваниях щитовидной железы (аутоиммунный тиреоидит, подострый тиреоидит);
] аллергических заболеваниях (ангионевротический отек Квинке, поллиноз, атопический дерматит, синдром Стивенса-Джонса, синдром Лайела), псориазе, экземе;
] воспалительных заболеваниях сосудистой оболочки глаз (увеиты).
Воздействие глюкокортикоидов на систему кроветворения иногда используют при лечении агранулоцитоза – состояния при котором в крови отсутствуют нейтрофилы (при этом резко снижается иммунитет, возникают некротические ангины, колиты, пневмонии). Обычно агранулоцитоз обусловлен воздействием ионизирующего излучения (лучевая болезнь) или токсических факторов (токсический агранулоцитоз).
У женщин с невынашиванием беременности введение глюкокортикоидов применяют для индукции синтеза сурфактанта у плода и подготовке легких будущего ребенка к самостоятельному дыханию. Если роды произошли преждевременно и ребенок недоношен более чем на 2 недели, то в его легких нет сурфактанта и ткань легких не может расправиться в момент первого вдоха (возникает дистресс-синдром новорожденных). В последующем в такой спавшейся ткани легкого возникает воспаление (ателектатическая пневмония) и альвеолы погибают, замещаясь хрящевыми мембранами (гиалиноз легких). Введение кортикостероидов перед родами позволяет запустить процесс синтеза сурфактанта раньше времени и подготовить ткани легких плода к самостоятельному дыханию.
Режим дозирования глюкокортикостероидов. Как правило при лечении того или иного заболевания указывают дозы стероидов в пересчете на преднизолон. При необходимости назначения другого стероида используют шкалу равноэквивалентных доз (см. таблицу). В настоящее время используют три принципиальные схемы введения глюкокортикостероидов.
· Непрерывное введение. Глюкокортикоиды применяют ежедневно, при этом суточную дозу вводят в 2 приема: ⅔ дозы утром в 7-8 часов и ⅓ дозы в 14-15 часов дня. При таком режиме введения моделируется естественный циркадианный ритм секреции глюкокортикоидов и они реже вызывают атрофию коры надпочечников.
· Альтернирующая терапия. Пациент по утрам через день получает двойную суточную дозу глюкокортикоидов. Такая схема терапии используется только после того, как течение заболевания стало стабильным. Этот вид терапии крайне редко вызывает нежелательные эффекты, т.к. между приемами лекарства сохраняется достаточный период покоя для восстановления нарушенных функций.
· Пульс-терапия. При этом режиме пациенту 1 раз в неделю внутривенно вводят 1000 мг метилпреднизолона в течение 30-60 мин. В последующие дни пациент либо не получает стероиды вообще, либо ему назначают минимальные дозы. Данный режим введения используют притяжелом течении заболевания, рефрактерности к традиционной терапии.
Нежелательные эффекты стероидной терапии. При непродолжительном использовании (менее 1 недели) даже умеренно больших доз серьезные нежелательные эффекты обычно не развиваются. Длительное лечение глюкокортикоидами сопровождается возникновением нежелательных эффектов у 50-80% пациентов. Все нежелательные эффекты стероидной терапии можно объединить в несколько групп:
· Эндокринные и метаболические нарушения:
1. Экзогенный синдром Иценко-Кушинга (гиперкортицизм). Характеризуется увеличением массы тела, особым внешним видом (лунообразное лицо, «бычья холка», гирсутизм, acne, багрово-красные стрии на коже) артериальной гипертензией, в крови у таких пациентов нейтрофилез, резко снижен уровень эозинофилов и лимфоцитов.
2. Атрофия коры надпочечников и угнетение гипоталамо-гипофизарно-надпочечниковой системы. При приеме стероидов в физиологических дозах (2,5-5,0 мг/сут по преднизолону) риск развития атрофии надпочечников минимален, но если используются более высокие дозы, то уже через 1-2 недели наблюдается угнетение коры надпочечников. Причем следует помнить, что если курс продолжался 2-3 недели, то на полное восстановление функции коры требуется от 6 до 12 месяцев.
3. Синдром «отмены» характеризуется резким ухудшением течения заболевания при внезапном прекращении применения стероидов, признаками надпочечниковой недостаточности: слабость, утомляемость, потеря аппетита, мышечные и суставные боли, повышение температуры. В тяжелых случаях возможен надпочечниковый криз - рвота, судороги, коллапс.
4. «Стероидный диабет» – характеризуется типичной картиной сахарного диабета, обусловлен увеличением гликемии крови, контринсулярным действием стероидов.
5. Гиперлипидемия, прогрессирование атеросклеротических поражений сосудов.
· Изменения со стороны костно-мышечной системы: остеопороз, патологические переломы костей – данный эффект связан с угнетением синтеза кальцитонина и увеличением продукции паратгормона, ускорением метаболизма кальция у пациентов, которые принимают глюкокортикоиды.
· Изменения со стороны кожи: наблюдается истончение и атрофия кожи. Наиболее часто этот эффект возникает при введении гормонов внутримышечно в плечо.
· ЖКТ: Возникновение «немых», т.е. бессимптомных язв 12-перстной кишки и желудка. Бессимптомность язв обусловлена воздействием стероидов, подавляющих воспалительный процесс и боль, которая возникает при формировании язвы.
· Сердечно-сосудистая система: отеки и гипокалиемия, которые обусловлены минералокортикоидным компонентом действия стероидов. В тяжелых случаях возможно возникновение артериальной гипертензии.
· ЦНС: общее возбуждение, психотические реакции (бред, галлюцинации) при введении в больших дозах. Возможно повышение внутричерепного давления с тошнотой и головной болью (синдром «псевдоопухоли мозга»).
· Органы зрения: глаукома, заднекапсулярная катаракта.
· Иммунитет и регенерация: прием глюкокортикоидов приводит к нарушению заживления ран, ослаблению противобактериального и противовирусного иммунитета: у пациента возникают диссеминированные бактериальные и вирусные инфекции, клиника которых стерта, т.к. стероиды устраняют типичное воспаление, боль, гипертемию. Достаточно часто прием стероидов и вызванный им иммунодефицит приводят к развитию кандидоза слизистых оболочек и кожи, возникновению туберкулеза.
· Тератогенный эффект.
Следует помнить, что все глюкокортикоиды не отличаются между собой по эффективности, но отличия заключаются в активности, длительности действия лекарственных средств, особенностям их фармакокинетики и частоты развития нежелательных эффектов (см. также табл. 1).
Глюкокортикоидные средства для системного применения.
Гидрокортизон (Hydrocortisone). Природный глюкокортикоидный гормон. По глюкокортикоидной активности уступает преднизолону, но по минералокортикоидной превосходит его в 3 раза.
 ФК: Выпускается в виде 2 эфиров: 1) гидрокортизона сукцинат – представляет собой легкорастворимый порошок, который может применяться для внутримышечного и внутривенного введения; 2) гидрокортизона ацетат – мелкокристаллическая суспензия, которую допустимо вводить только внутримышечно или в полость сустава.
ФК: Выпускается в виде 2 эфиров: 1) гидрокортизона сукцинат – представляет собой легкорастворимый порошок, который может применяться для внутримышечного и внутривенного введения; 2) гидрокортизона ацетат – мелкокристаллическая суспензия, которую допустимо вводить только внутримышечно или в полость сустава.
В крови гидрокортизон на 90% связан с белками крови (80% с транскортином и 10% с альбумином). Биологически активными являются только 10% свободной фракции гидрокортизона. Гидрокортизон может хорошо проникать во все органы и ткани, в т.ч. и через плаценту. Однако, в плаценте имеется фермент 11b-дегидрогеназа, который превращает более 67% гидрокортизона в неактивный 11-кето-гидрокортизон. Поэтому, данное лекарственное средство может применяться по жизненным показаниям у беременных женщин, т.к. его влияние на плод будет сведено к минимуму.
Применение и режим дозирования. В настоящее время гидрокортизон используют достаточно редко, главным образом при заместительной терапии острой надпочечниковой недостаточности (внутривенно в дозе 100-500 мг/сут как правило не более 48-72 часов), а также местно:
· ретробульбарно при воспалительных заболеваниях глаз по 5-20 мг 1 раз в неделю;
· накожно в виде мазей, кремов, лосьонов при кожных аллергических заболеваниях, псориазе, экземе 2-3 раза в день наносят на места поражения не втирая ее, продолжительность курса лечения не более 2-3 недель;
· ректально в виде микроклизм при неспецифическом язвенном колите, болезни Крона по 5-50 мг на клизму ежедневно или через день;
· внутрисуставно при ревматоидном артрите и др. системных коллагенозах по 5-25 мг в полость «сухого» сустава (т.е. при отсутствии экссудата в полости сустава) 1 раз в 1-3 недели всего на курс до 6 инъекций.
ФВ: 0,5 1 и 2,5% мазь глазная по 2,5 и 3,0 г; 0,1% крем по 15,0 г и 0,1 лосьон по 20 мл;
суспензия гидрокортизона ацетата 2,5% в ампулах по 1 и 2 мл;
порошок гидрокортизона сукцината по 500 мг во флаконах.
Преднизолон (Prednisolone). Синтетический глюкокортикоид, который рассматривают как эталонное средство в этой группе. Сочетает высокую глюкокортикоидную активность и умеренную минералокортикоидную.
 ФК: фосфатный и гемисукцинатный эфиры преднизолона представляют собой легкорастворимые соли, которые можно вводить как внутримышечно, так и внутривенно; ацетатный эфир преднизолона – микрокристаллическая суспензия, поэтому его можно вводить только внутримышечно.
ФК: фосфатный и гемисукцинатный эфиры преднизолона представляют собой легкорастворимые соли, которые можно вводить как внутримышечно, так и внутривенно; ацетатный эфир преднизолона – микрокристаллическая суспензия, поэтому его можно вводить только внутримышечно.
После введения преднизолон на 90% связан с белками крови (»50% с транскортином и 40% с альбумином). Хорошо проникает во все органы и ткани, подобно гидрокортизону 51% преднизолона разрушается 11b-дегидрогеназой плаценты до 11-кето-преднизолона. Поэтому он относительно безопасен для плода и может применяться по жизненным показаниям у беременных женщин.
Применение и режим дозирования. Преднизолон применяют для всех видов глюкокортикоидной терапии. При пероральном введении дозы составляют 15-100 мг/сут (в случае лечения гемобластозов – 40-60 мг/м2 поверхности тела в сутки). При введении в полость суставов он назначается в дозах 5-50 мг 1 раз в неделю. Внутривенное введение используют при тяжелых системных аллергических реакциях или астматическом статусе, при этом доза может достигать 400-1200 мг (в настоящее время считают, что при астматическом статусе предельной дозы преднизолона нет, единственный критерий величины дозы – купирование статуса). Местные аппликации преднизолона при кожных и глазных заболеваниях проводят 2-3 раза в день (лекарство наносят на очаг поражения не втирая его).
ФВ: таблетки по 5, 10 и 20 мг; мазь 0,5%-10,0; раствор преднизолона фосфата 30 мг/мл (3%) ампулы по 1 мл; порошок преднизолона гемисукцината в ампулах по 10, 25, 50 и 250 мг; суспензия преднизолона ацетата в ампулах по 10, 20, 25 и 50 мг; капли во флаконах 0,5%-10 мл.
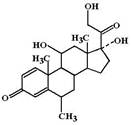 Метилпреднизолон (Methylprednisolone, Medrol). По сравнению с преднизолоном обладает на 20% большим глюкокортикоидным эффектом и практически лишен минералокортикоидной активности. В отличие от преднизолона и других кортикостероидов крайне редко вызывает нежелательные эффекты со стороны сердечно-сосудистой системы, ЖКТ и ЦНС, поэтому метилпреднизолон рекомендуется для проведения высокодозной глюкокортикоидной терапии, пульс-терапии.
Метилпреднизолон (Methylprednisolone, Medrol). По сравнению с преднизолоном обладает на 20% большим глюкокортикоидным эффектом и практически лишен минералокортикоидной активности. В отличие от преднизолона и других кортикостероидов крайне редко вызывает нежелательные эффекты со стороны сердечно-сосудистой системы, ЖКТ и ЦНС, поэтому метилпреднизолон рекомендуется для проведения высокодозной глюкокортикоидной терапии, пульс-терапии.
Применение и режим дозирования. Внутрь метилпреднизолон применяют в дозе 4-96 мг/сут, депо-форму можно вводить внутримышечно 40-120 мг 1 раз в неделю (на курс 1-4 инъекции). При проведении пульс-терапии 1000 мг метилпреднизолона растворяют в 100 мл физиологического раствора и вводят в течение 30-60 мин 1 раз в неделю.
Иногда метилпреднизолон применяют для профилактики рвоты при лечении цитостатическими средствами у онкологических пациентов. В этом случае метилпреднизолон назначают в дозе 250 мг за 20 мин до приема химиопрепарата и повторно в такой же дозе через 6 часов после их приема.
ФВ: таблетки по 4 и 16 мг; порошок во флаконах по 250, 500, 1000 и 2000 мг; суспензия метилпреднизолона ацетата флаконы по 40 мг.
Дексаметазон (Dexamethasone, Dexasone). Фторированный синтетический глюкокортикостероид. Одно из наиболее мощных глюкокортикоидных соединений – в 7 раз сильнее преднизолона по глюкокортикоидной активности, лишен минералокортикоидной активности.
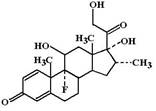 Вызывает сильное и длительное угнетение гипоталамо-гипофизарно-надпочечниковой системы, выраженные нарушения углеводного и жирового обменов, он часто способен вызвать психотические реакции. Дексаметазон обладает ярким дегидратирующим действием на ткани, особенно на ткани мозга. В связи с этим, его рекомендуют включать в схемы терапии отека мозга.
Вызывает сильное и длительное угнетение гипоталамо-гипофизарно-надпочечниковой системы, выраженные нарушения углеводного и жирового обменов, он часто способен вызвать психотические реакции. Дексаметазон обладает ярким дегидратирующим действием на ткани, особенно на ткани мозга. В связи с этим, его рекомендуют включать в схемы терапии отека мозга.
ФК: В отличие от нефторированных глюкокортикоидов после всасывания он только на 60% связывается с белками крови (главным образом с альбумином, а не транскортином). Доля биологически активной свободной фракции составляет около 40%.
Дексаметазон (как и другие фторированные стероиды) устойчив к действию 11b-дегидрогеназы плаценты и в неактивный 11-кето-дексаметазон конвертируется только 2% поступившего в плаценту вещества, поэтому дексаметазон хорошо проникает в ткани плода и эффективно стимулирует процессы синтеза сурфактанта и созревания легких.
Применение и режим дозирования. Внутрь назначают по 2-15 мг/сут в 1 или 2 приема, внутривенно или внутримышечно вводят по 4-20 мг/сут, в полость суставов по 2-8 мг каждые 3 дня-3 недели.
· При отеке мозга дексаметазон вводят внутривенно в дозе 10 мг, затем введение повторяют каждые 6 часов в дозе 4 мг внутримышечно до устранения симптомов. Лечение продолжают не менее 2-4 дней после стабилизации состояния, в последующем постепенно в течение 5-7 дней проводят отмену дексаметазона.
· Для профилактики рвоты у пациентов, получающих цитостатическую терапию дексаметазон вводят по 10 мг за 20 минут до приема цитостатика и через 6 часов после его введения.
· Для стимуляции синтеза сурфактанта у плода при невынашивании беременности дексаметазон назначают беременной женщине в дозе 5 мг 3 раза в день (оптимальный курс – 5 дней).
ФВ: таблетки по 0,5 и 1,5 мг; раствор дексаметазона фосфата 0,4% в ампулах по 1 и 2 мл.
Триамцинолон (Triamcinilone, Polcortolon). Является фторированным синтетическим глюкокортикоидным средством. По активности сопоставим с метилпреднизолоном. При его применении часто возникают нежелательные эффекты со стороны кожи (стрии, кровоизлияния, гирсутизм) и мышц («триамцинолоновая» миопатия).
 По фармакокинетическим параметрам напоминает дексаметазон, однако, с белком плазмы связывается крайне слабо:»40% лекарства связано с альбуминами плазмы, а 60% представляют собой свободную биологически активную фракцию. В процессе метаболизма триамцинолона образуется 3 метаболита, причем 2 из них обладают фармакологической активностью.
По фармакокинетическим параметрам напоминает дексаметазон, однако, с белком плазмы связывается крайне слабо:»40% лекарства связано с альбуминами плазмы, а 60% представляют собой свободную биологически активную фракцию. В процессе метаболизма триамцинолона образуется 3 метаболита, причем 2 из них обладают фармакологической активностью.
Режим дозирования: внутрь принимают в дозе 4-48 мг/сут в 2 приема, внутримышечно и в полость сустава вводят по 40-80 мг 1 раз в месяц (в виде депо-препарата кеналога), местно применяют в виде мази, которую апплицируют на пораженную область 2-3 раза в день.
ФВ: таблетки по 2, 4 и 8 мг, суспензия триацинолона цетонида 10 и 40 мг/мл (1 и 4%) в ампулах по 1 мл (Kenalog), мазь 0,1%-15,0.
Таблица 1. Сравнительная характеристика средств с глюкокортикоидной активностью.
| Средство | активность | “ АД | язвы ЖКТ | психоз | эквив. доза | биодоступн., per os | t½, сут ткани | |
| ГКС | МКС | |||||||
| гидрокортизон | ËËËË | ËËËË | ËËËË | 0,25-0,5 | ||||
| преднизолон | 0,3 | ËË | ËËË | ËËË | 0,5-1,5 | |||
| метилпреднизолон | Ë | Ë | Ë | 0,5-1,5 | ||||
| дексаметазон | ËËË | ËËËË | ËËË | 0,75 | 1,5-3,0 | |||
| триамцинолон | Ë | Ë | ËËË | 0,5-1,5 | ||||
| флюметазон | 100* | 1,5-3,0 | ||||||
| беклометазон | 500* | 0,6 | 1,5-3,0 | |||||
| будесонид | 1000* | 1,1 | 1,5-3,0 |
Примечание: * - при местном применении в сравнении с гидрокортизоном.
Глюкокортикоидные средства для местного применения.
Беклометазон (Beclometasone, Becotide). Используется для ингаляционного применения при лечении аллергических заболеваний дыхательных путей: поллиноз, бронхиал
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 954; Нарушение авторских прав?; Мы поможем в написании вашей работы!