
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Rad6-зависимая пострепликативная репарация
|
|
|
|
Процесс пострепликативной репарации (PRR, post replication repair) у дрожжей называется еще Rad6-зависимой репарацией, так как была обнаружена группа белков, эпистатически связанных с Rad6 и вовлеченных в этот процесс. Rad6-зависимый путь PRR является эволюционно консервативным: у E.coli гомолог Rad6 вовлечен в процесс ресинтеза (рестарта репликации) при SOS-ответе, гомологи найдены у S.pombe и мыши, причем участвуют в сходных процессах обхода повреждения. Rad6-зависимый путь контролируется белками Rad6 и Rad18, образующими гетеродимер, способный к связыванию с ДНК и обладающий убиквитин-связывающей активностью.
Гетеродимер Rad6/Rad18 и белок Rad5 необходимы для одного из путей пострепликативной репарации. Rad6 является классическим Е2-убиквитин-связывающим ферментом, образующим множество убиквитиновых цепей через связывание лизином в 48 положении. Rad18 является ДНК-связывающим белком с убиквитин-лигазной активностью. Комплекс Ubc13/Mms2 также является Е2-убиквитин-связывающим ферментом, но формирует убиквитиновые цепи через лизин в 63 положении. Rad5 является ДНК-связывающим белком, который привлекает комплекс Ubc13/Mms2 к ДНК, а также служит связующим звеном между комплексами Ubc13/Mms2 и Rad6/Rad18. Функции этих белков пока точно не определены, но их гомологи существуют и у млекопитающих. Rad6 имеет два гомолога в клетках человека, с которыми взаимодействует человеческий гомолог Rad18 (hRad18). Участие самого hRad18 в пострепликативной репарации доказано. Ген Mms2 считается частью безошибочного пути PRR, контролируемого Rad6, его продукт способен образовывать прочный комплекс с белком Ubc13, который в свою очередь способен к альтернативному убиквитинированию лизина в 63 положении.
Белок Rad18 обладает способностью связываться с однонитевой ДНК, таким образом комплекс Rad6Rad18 способен связаться с остановившейся вилкой репликации, так как там имеется однонитевой «хвост». При этом Rad6 может убиквитинировать белки остановившегося комплекса репликации.
Мутагенный путь пострепликативной репарации основан на способности полимераз семейства Y вести синтез на поврежденной матрице. Это процесс аналогичный SOS-репарации у прокариот. Вероятнее всего, убиквитинирование процессивной ДНК-полимеразы δ необходимо для ее деградации или перемещения, позволяющего полимеразам Y-семейства занять ее место и провести синтез на поврежденной матрице.
Безошибочный путь пострепликативной репарации состоит из одного из вариантов синтеза на поврежденной матрице (Rad30-зависимого) и путей обхода повреждений, для которых необходимы белки Rad5, Mms2, Ubc13, Srs2, а также ДНК-полимераза-δ, PCNA и некоторые белки гомологической рекомбинации. Схема этого процесса предложена на рис. 38.
О низкопроцессивных ДНК-полимеразах эукариот, участвующих в процессе «прохода» повреждении, мы уже подробно говорили при изучении SOS-ответа у E.coli.
Rad5 является членом семейства SWI/SNF, как и CSA, обладая АТФазной активностью. Он может способствовать ремоделированию хроматина и помогать белкам репарации подойти к ДНК, а также участвовать в переключении матрицы при остановке вилки репликации. Это делает его одним из главных игроков.
PCNA может быть моноубиквитинирован Rad6 и Rad18, полиубиквитинирован Rad6, Rad18, Rad5, Mms2, Ubc13, и «сумоирован» Ubc9, что играет важную роль в выборе субпути Rad6– зависимой PRR. Таким образом различные модификации PCNA могут определять тот тип репарации, который будет использован при ресинтезе (рестарте репликации). Связаны ли модификации PCNA с внутри S-фазными чекпойнт-функциями не ясно.
Ген Srs2 является гомологом ДНК-геликазы UvrD E.coli и проявляет антирекомбинационную активность, антагонистическую активности Rad51 – то есть он способен разрушать его активные филаменты. Интересно, что Srs2 способен взаимодействовать с pol32 – субъединицей ДНК-полимеразы-δ. Во время чек-пойнт ответа на повреждение ДНК Srs2 может быть фосфорелирован Mec1 и Rad53 —киназами. Именно этот белок может быть мишенью чек-пойнт-киназ в комплексе белков остановившейся вилки репликации внутри S-фазы. Вероятно, у него есть еще дополнительные функции вне PRR. В то же время Srs2, Mec1и Rad5 могут кооперироваться в осуществлении независимого от рекомбинации Ресинтеза (рестарта репликации). Таким образом, выбор субпути может также зависеть от регуляции клеточного цикла – то есть от чекпойнт-ответа.
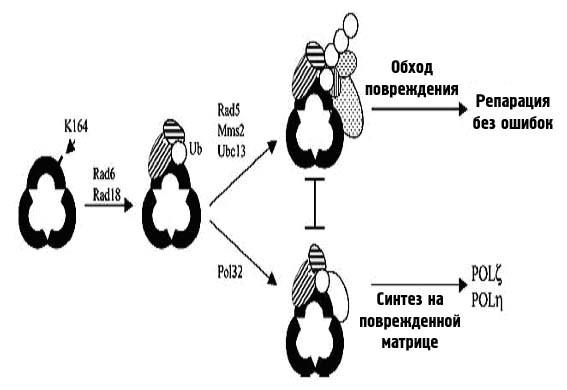
Рисунок 38. Два пути пострепликативной репарации у эукариот.
Возможно, что сам Rad51 является ингибитором однонитевого отжига по прямым повторам (вытесняя Rad52). Вероятно, Rad51-зависимую рекомбинацию можно считать репликацией, индуцированной разрывами. Мишенью для Rad51 могут служить не только однонитевые бреши, но и отожженные друг на друге вновь синтезированные сестринские хроматиды остановившейся вилки репликации, так как там есть двунитевые концы, или просто разрушающаяся вилка с двойными концами ДНК.
Роль чекпойнт-сигналов и привлечения факторов репарации в процессах пострепликативной репарации до конца неясно.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 740; Нарушение авторских прав?; Мы поможем в написании вашей работы!