
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Генеральные концепции и основные игроки
|
|
|
|
Чекпойнты повреждений ДНК определяются как система взаимодействующих путей, работающих совместно, распознавая повреждения в ДНК и вызывая клеточный ответ. Процесс передачи сигнала и участвующие в нем белки формально разделяются на сенсоры, переносчики и эффекторы, как показано в табл. 7. Сенсоры прямо или опосредованно распознают повреждения ДНК, служат сигналом этих нарушений и инициируют каскад биохимических реакций. Переносчиками обычно являются протеинкиназы, которые изменяют и усиливают сигнал о повреждениях от сенсоров, фосфорелируя другие киназы или нижележащие белки– мишени. Эффекторные белки включают самые последние нижележащие мишени протенкиназ – переносчиков сигнала. Эффекторный уровень чекпойнта повреждений ДНК пересекается с машиной клеточного цикла. В таблице приведены белки, которые сейчас считаются основными сенсорами и переносчиками. Впервые мы употребляли эти термины, описывая процессы репарации двунитевых разрывов ДНК.
До сих пор остается неясным самый первый шаг в распознавании ДНК-повреждений. Первоначально кандидатами на роль первичных сенсоров были признаны два белка, способные непосредственно активироваться при связывании с одно– и двунитевыми разрывами ДНК. Это, соответственно, полимераза поли(АДФ) – рибозы PARP и ДНК-зависимая протеинкиназа DNA-PK. Однако вскоре стало ясно, что эти белки не яляются необходимыми для инициации глобального ответа клетки на повреждения, и имеют только локальное значение, хотя DNA-PK, вероятно, каким-то образом способствует восстановлению S-фазы после задержки.
В работах на бактериях, а затем на эукариотических клетках было показано, что однонитевая ДНК способна инициировать сигнал для некоторых путей репарации. Но это не стыкуется с представлением о том, что чекпойнт-сигналы связаны с двунитевыми разрывами ДНК, то есть инициируются двунитевой ДНК и/или связанными с ней изменениями конформации хроматина. Если это так, то те пути репарации, при которых образуются протяженные участки двунитевой ДНК должны генерировать более сильный чекпойнт-ответ, чем те, при которых количество двунитевый ДНК ограничено. То есть, негомологическое воссоединение концов будет давать более слабый сигнал, чем гомологическая рекомбинация, при которой в процесс репарации вовлечены более протяженные участки двунитевой ДНК.
Таблица 7. Белки чекпойнт-ответа клетки на повреждение ДНК.

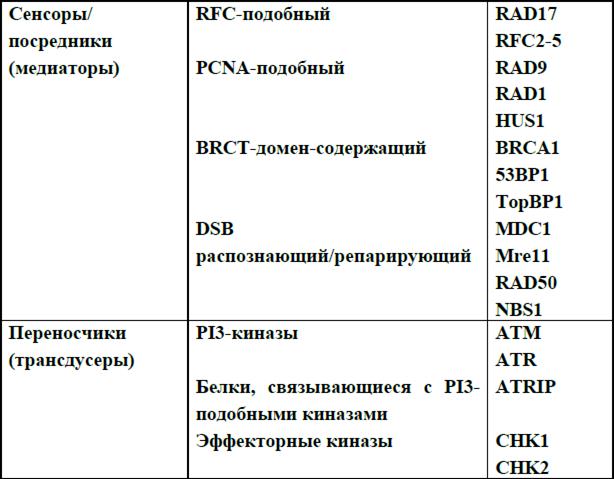
В настоящее время работы на дрожжевых моделях выявили два белковых комплекса – кандидата на роль сенсоров: Rad17-RFC и 9-1-1, о которых мы говорили, изучая остановку репликации при повреждении ДНК. У этих комплексов есть функциональные гомологи в системе репликации ДНК и их функции частично подобны таковым при чекпойнт-ответе. Rad17-RFC комплекс состоит из Rad17и четырех небольших субъединиц репликативного комплекса RFC (RFC2, RFC3, RFC4, RFC5), состоящего из 5 субъединиц. RFC распознает и связывается с узлом однонитевой /двунитевой ДНК и способствует «загрузке» на ДНК гомотримерного белка, обладающего «зажим»-подобной структурой, необходимого для усиления процессивности ДНК-полимераз δ и ε. Это подтверждает точку зрения, что Rad17-RFC комплекс служит «загрузчиком» комплекса 9-1-1 на поврежденную ДНК. 9-1-1 комплекс состоит из субъединиц RAD9, HUS1 и RAD1, которые взаимодействуют между собой и образуют PCNA-подобную структуру, которая «загружается» на ДНК как скользящий зажим, так же как и PCNA. Есть предположение, что 9-1-1 комплекс также увеличивает количество вовлеченной в реакцию двунитевой ДНК для того, чтобы усилить чекпойнт-ответ. К сожалению, до сих пор остается неясным, как именно RAD17-RFC и 9-1-1 комплексы вовлечены в процесс инициации сигнала на двунитевых разрывах и вообще функционируют во время хорошо известных путей репарации двунивых разрывов ДНК.
Другие белки, такие как комплекс Mre11-RAD50-NBS1 и BRCA1 участвуют в распознавании именно двунитевых разрывов ДНК. BRCA1, вероятно, является адаптором, предоставляющим дополнительные мишени для фосфорелирования киназам-переносчикам сигнала, он взаимодействует с большим числом белков, вовлеченных в процессы репарации ДНК, и собирает белковый комплекс, вероятно, участвующий в инициации и передаче сигнала (BASC – BRCA1 associated genom surveillance complex). Каковы основные функции BRCA1 – сенсорные или трансдусерные – до сих пор неясно.
Белки, называемые медиаторами, прототипом которых является дрожжевой RAD9, участвуют в передаче сигнала. Они содержат два повторяющихся домена, обнаруженных в С-конце белка BRCA1 и названных поэтому BRCТ-доменами. BRCТ-содержащие белки найдены у млекопитающих, но имеют функции, сходные с таковыми дрожжевого RAD9. Среди подобных белков описаны BRCA1, TopBP1 (topoisomerase II binding protein I), 53BP1 (P53 binding protein I) и MDC1 (mediator of DNA damage checkpoint protein I). Все эти белки вовлечены в чекпойнт-ответ, они распознают повреждения ДНК и привлекают другие белки, которые облегчают передачу сигнала вниз и репарацию ДНК.
Две активно изучаемые киназы из семейсва PI3-киназ (фосфоинозитол-3-киназы) ATM и ATR работают непосредственно сразу же после сенсоров повреждений. АТМ играет решающую роль в чекпойнтах повреждений ДНК, контролируя начальное фосфорилирование многих ключевых белков общего ответа, например таких, как Р53, MDM2, BRCA1, CHK2, MDC1 и NSB1. При отсутствии АТМ ее функции частично берет на себя ATR, сходная с ней по структуре и хуже изученная, так как нокаутные по этому гену мыши гибнут в эмбриогенезе, а клетки в культуре нежизнеспособны. Ассоциированный с ATR человеческий синдром (синдром Секеля) выявлен всего два года назад.
Не ясно до конца, каким именно образом ATR и ATM активируются сами (взаимное фосфорилирование АТМ в гомодимере) в ответ на различные воздействия, и как они помогают другим белкам связываться с ДНК (по принципу Ku и DNA-PK). Недавно показано, что ATR образует гетеродимер со специфическим белком ATRIP (ATR interacting protein I), что важно для чекпойнт-сигнала, хотя механизм этой важности остается неизвестным. Может быть подобный партнер существует и у АТМ.
Современные данные утверждают, что именно АТМ определяет ранний чекпойнт-ответ, а ATR действует позднее, когда уже идет репарация ДНК повреждений, как вызванных радиацией, так и ультрафиолетом или остановкой репликативных вилок.
Следующим шагом в генерации чекпойнт-ответа является активация СНК1 и СНК2 киназ (checkpint kinase 1 and 2). Эти структурно неродственные киназы имеют частично перекрывающуюся специфичность, то есть часто фосфорилируют одни и те же белки. СНК2 фосфорилируется АТМ, что приводит к ее активации. СНК1 фосфорилируется по серину-345 ATR в ответ на действие ультрафиолета или гидроксимочевины. Таким образом в процессе формирования чекпойт-ответа АТМ функционально связана с СНК2, а ATR – с СНК1.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 502; Нарушение авторских прав?; Мы поможем в написании вашей работы!