
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Цвиттер-ион
|
|
|
|
В зависимости от рН–среды АК могут быть в виде анионов, катионов, нейтральных биполярных ионов или в виде смеси их форм.
В сильнокислой среде АК присутствуют в виде катионов (q +)

в сильнощелочной среде – в виде анионов (–q)
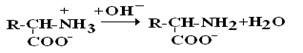
Величина рН, при которой в водном растворе преобладает цвиттер-ион, т.е. равновесная концентрация «+» и «–» q аминокислот, а также белков, называется изоэлектрической точкой (pI). При достижении такой рН белок становится неподвижным в электрическом поле и выпадает в осадок, что используется в электрофоретических методах анализа белков и аминокислот.
Стереохимия аминокислот.
Важным свойством АК является их оптическая активность в водных растворах. Это свойство АК обусловлено наличием в их структуре хирального атома С. Хиральным атомом или хиральным центром называется атом, у которого все связи замещены различными радикалами (R):

| 
|
Оптически неактивной является только АК глицин, которая не имеет хирального центра.
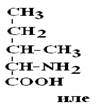
Существуют два вида изомеров – структурные и стереоизомеры.
Структурные изомеры – это вещества с одинаковой Mr, но различной последовательностью связывания атомов в молекуле.
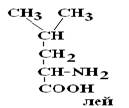
| 
|
Стереоизомеры – это изомеры с одинаковой последовательностью соединения атомов, но с различным их расположением в пространстве.
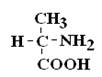
| 
|
Если 2 стереоизомера относятся друг к другу как предмет и его зеркальное отражение, их называют энантиомерами.
Энантиомеры всегда проявляют одинаковые химические и физические свойства за исключением одного – направления вращения плоскости поляризованного луча. Энантиомер, вращающий плоскость поляризации по часовой стрелке, называется правовращающим («+»), а против часовой стрелки – л евовращающим («–»). Природные аминокислоты являются как «+», так и «–».
Смесь равного количества молекул правого и левого энантиомеров называется рацемической смесью.
Рацематы не обладают оптической активностью. По пространственному расположению атомов и радикалов вокруг хирального центра различают аминокислоты Д– и L– ряда. Для определения принадлежности АК к Д– или L– ряду сравнивают конфигурацию ее хирального центра с энантиомером глицеральдегида (ГА).
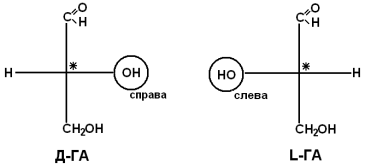
По аналогии, в аминокислотах если NH2–группа расположена справа от оси СООН-R, то это Д–АК, а если слева – L–АК.
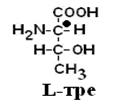
| 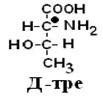
|
Все аминокислоты природных белков являются α–АК.
Современная рациональная классификация аминокислот
в соответствии с ней все аминокислоты делятся на 4 группы.
I. Неполярные гидрофобные аминокислоты – их 8.
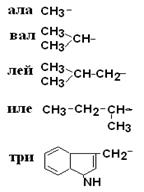
| Аланин Валин Лейцин Изолейцин Триптофан | 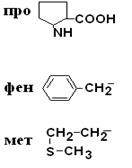
| Пролин Фенилаланин Метионин |
II. Полярные гидрофильные незаряженные аминокислоты – их 7.
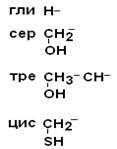
| Глицин Серин Треонин Цистеин | 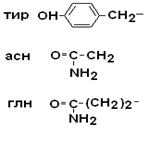
| Тирозин Аспарагин Глутамин |
III. Отрицательно заряженные кислые аминокислоты
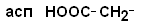
| Аспарагиновая кислота |

| Глутаминовая кислота |
IV. Положительно заряженные основные аминокислоты

| Лизин Аргинин |

| Гистидин |
Образование пептидных связей.
a–СООН группа одной аминокислоты может реагировать с a–NH2 группой другой аминокислоты с образованием пептидных связей.
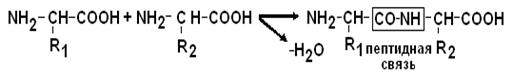
|
Пептидные цепи белков – это линейные полимеры a–АК, соединенных пептидной связью.
Мономеры аминокислот, входящих в состав полипептидов, называются аминокислотными остатками, цепь повторяющихся групп –NH–CH–CO– называется пептидным остовом. Аминокислотный остаток, имеющий свободную NH2–группу называется N–концевым, а имеющий свободным α–карбоксигруппу – С–концевым.
Пептиды пишутся и читаются с N–конца.
Пептидная связь, образуемая аминогруппой пролина, отличается от других пептидных связей: у атома азота пептидной группы отсутствует водород, вместо него имеется связь с R.
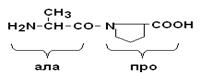
Пептидные связи очень прочные, для их неферментного гидролиза in vitro требуются жесткие условия: высокие t° и r, кислая среда, длительное время. In vivo, где нет таких условий, пептидные связи могут разрываться с помощью протеолитических ферментов (E), называемых протеазами или пептидгидролазами.
Полипептидная теория строения белков была предложена в 1902 г. Э.Фишером, в ходе дальнейшего развития биохимии эта теория была экспериментально доказана.
Экспериментальные доказательства полипептидного строения белков
1. Титруются только концевые COOH– и NH2– группы.
2. При гидролизе белков образуется стехеометрическое количество титруемых COOH– и NH2–групп (происходит распад определенного числа пептидных связей).
3. Под действием протеолитических ферментов (протеаз) белки расщепляются на строго определенные фрагменты с концевыми аминокислотами, соответствующими избирательному действию протеаз.
4. Биуретовую реакцию (раствор сульфата меди CuSO4 в щелочной среде – сине-фиолетовое окрашивание) дают и биурет (NH2–CO–NH–CO–NH2), содержащий пептидную связь и белки.
5. Проведенный рентгеноструктурный анализ (разрешительная способность 0,15-0,2 нм) показывает на рентгенограмме пептидную связь.
6. Самое убедительное доказательство – это синтез химическими методами белков с уже расшифрованной структурой. Синтезированные белки обладают физико-химическими свойствами и биологической активностью, аналогичными природным белкам.
ЛЕКЦИЯ 2
ТЕМА: СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВЫХ МОЛЕКУЛ.
Цель: Выработать у студентов общие представления о сложных уровнях структурной организации белков, дать характеристику каждого уровня, их главных движущих сил стабилизации и патологиях, возникающих при нарушении ПСБ.
ПЛАН ЛЕКЦИИ
1. Классификация белков: простые и сложные белки, пептиды, их состав, физико-химические свойства белков, основные представители.
2. Гемопротеиды – виды гемоглобинов крови, химический и структурный состав.
3. Первичная структура белка – характеристика (на примере инсулина). Основная движущая сила стабилизации первичной структуры белка.
4. Вторичная структура белка, ее виды: α-спираль, β-структура, беспорядочный клубок, характеристика видов. Основная движущая сила стабилизации вторичной структуры белков.
5. Третичная структура белков, ее формирование и стабилизация. Значение сохранности третичной структуры для биологической активности белков.
6. Дать понятие о ренатурации и денатурации белков.
7. Четвертичная структура белков, ее формирование. Основная движущая сила сохранности четвертичной структуры белков.
8. Наследственные изменения первичной структуры. Гемоглобинозы: гемоглобинопатии и талассемии.
Классификация белков
В зависимости от химического состава белки делятся на 3 группы:
1) простые (протеины);
2) пептиды;
3) сложные (протеиды).
1. Простые белки построены из аминокислот и при гидролизе распадаются только на аминокислоты.
Протамины и гистоны – содержат до 85% аргинина, поэтому имеют выраженные основные свойства.
Белок сальмин, полученный из молок семги; клупеин – из молок сельди, скорее относятся к пептидам, т.к. имеют Mr не более 5000 Да.
Протамины в основном являются белковой частью нуклеотидов (ДНК). Гистоны сосредоточены главным образом в ядре и представляют белковую часть РНК.
Проламины и глютелины – белки растительного происхождения: зеин получают из кукурузы, глютеин - из пшеницы. Содержат до 25% глу, 10-15% про.
Альбумины и глобулины – содержатся в сыворотке крови, молоке, яичном белке, мышцах и т.д. Это глобулярные белки, отличающиеся различной растворимостью (альбумины растворяются лучше), по Mr (альбумины имеют молекулярную массу, равную 69000 Да, глобулины - 150000Да).
2. Пептиды – это низкомолекулярные азотсодержащие соединения, состоящие из остатков аминокислот и имеющие молекулярную массу менее 5000 Да.
а) с гормональной активностью (АКТГ, окситоцин, вазопрессин и др.);
б) участвующие в процессах пищеварения (секретин, гастрин);
в) содержащиеся в α2-глобулярной фракции сыворотки крови (брадикинин, ангиотензин);
г) нейропептиды (рилизинг-факторы гормонов, например нейрофизины I и II гипоталамуса, способствуют выделению гормонов окситоцина и вазопрессина).
3. Сложные белки или протеиды – состоят из двух частей: белковой и небелковой. Небелковую часть называют простетической группой, а белковую часть, утратившую простетическую группу, называют апобелком.
| Название сложных белков | Простетическая группа |
| 1. Хромопротеиды в т.ч. гемопротеиды, флавопротеиды | окрашенный небелковый компонент гемовое железо производное изоаллоксазина ФАД, ФНН |
| 2. Нуклеопротеиды | РНК, ДНК |
| 3. Липопротеиды | липиды |
| 4. Гликопротеиды | олигосахариды, простые сахара |
| 5. Протеогликаны | полисахариды |
| 6. Металлопротеиды | негемовое железо, другие атомы металлов |
Подробно рассмотрим группу гемопротеидов – это Hb и его производное миоглобин (белок мышечной ткани), хлорофиллсодержащие белки и ферменты (цитохромы b, С, С1, каталаза, пероксидаза). Все они в качестве простетических групп содержат Fe (или Mg) – порфирины, а отличаются белковой частью.

Структуру гема впервые раскрыл Ненцкий, а его синтез провел Фишер.
HbA1 – основной представитель Hb крови взрослого человека;
Фетальный HbF – в крови новорожденного содержится до 80%, к концу 1-го года жизни он почти полностью заменяется на HbA1.
HbA состоит из 4 ППЦ: 2α–субъединиц и 2b–субъединиц. Четыре субъединицы или протомера ППЦ гемоглобина связаны друг с другом гидрофобными взаимодействиями. Молекула гемоглобина диссоциирует на два димера - ab и a1b1. Каждый протомер содержит гем, находящийся в гидрофобной «нише», защищающей его от окисления в ферри-форму. Mr ППЦ гемоглобина равна 64458 (64500) Да.

В основе простетической группы Нbлежит протопорфирин, у которого имеются: в положении 1,3,5,8- СН3– метильный R; в положении 2,4 СН2=СН– винильнный R; в положении 6,7 СООН–СН2–СН2 – остатки пропионовой кислоты. Железо, входящее в состав гемоглобина, имеет 2 ковалентные и 4 координационные связи; четыре связи образуют связи с атомами азота, пятая координационная связь присоединяет кислород к гему, шестая – связывает гем и ППЦ.
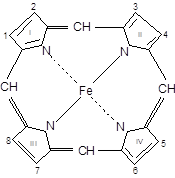
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 3783; Нарушение авторских прав?; Мы поможем в написании вашей работы!