
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модель идеального газа. Уравнение состояния идеального газа
|
|
|
|
Идеальный газ – это газ, у которого:
1) собственный объем молекул пренебрежимо мал по сравнению с объемом сосуда;
2) столкновения молекул газа между собой и со стенками сосуда происходят по закону абсолютно упругого удара;
2) других видов взаимодействия нет.
В простейшем случае равновесное состояние системы определяется значением трех параметров (p,V,T). Масса системы предполагается известной.
Опытным путем было установлено, что при обычных условиях (т.е. при комнатной Т и атмосферном р), параметры состояния таких газов, как O2, N2 подчиняются уравнению 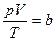 , где b=const, пропорциональная массе газа. Это уравнение называют уравнением Клайперона. Чем разреженнее газ, тем точнее выполняется это уравнение.
, где b=const, пропорциональная массе газа. Это уравнение называют уравнением Клайперона. Чем разреженнее газ, тем точнее выполняется это уравнение.
В соответствии с законом Авогадро, при нормальных условиях (температуре 0о С и давлении 101,3 кПа) 1 моль любого газа занимает объем 22,4 литра. Поэтому, что когда количество газа будет равно 1 молю, константа b будет одинаковой для всех газов: 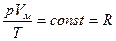 . (1)
. (1)
Обозначим константу буквой R (Vм - молярный объем).
Или 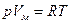 - мы получили уравнение состояния идеального газа.
- мы получили уравнение состояния идеального газа.
R называют универсальной газовой постоянной, она равна 8,31 Дж/(моль К).
Чтобы получить уравнение для произвольной массы газа m, умножим обе части уравнения (1) на отношение m / 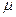 , где
, где 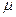 - молярная масса.:
- молярная масса.:
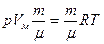 ,
, 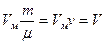 , т.е. объем массы газа m..
, т.е. объем массы газа m..
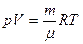 (2) - уравнение состояние для идеального газа массы m.
(2) - уравнение состояние для идеального газа массы m.
Умножим и разделим правую часть уравнения (2) на NA: 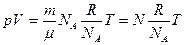 ,
,
где 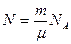 - число молекул, содержащихся в массе m газа.
- число молекул, содержащихся в массе m газа.
Величину 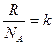 называют постоянной Больцмана (в честь австрийского физика Людвига Больцмана). Она определяет «долю» газовой постоянной, приходящуюся на одну молекулу, k=1,38 10-23 Дж/К. С учетом этого, можно записать
называют постоянной Больцмана (в честь австрийского физика Людвига Больцмана). Она определяет «долю» газовой постоянной, приходящуюся на одну молекулу, k=1,38 10-23 Дж/К. С учетом этого, можно записать 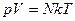 .
.
Разделим обе части на объем газа: 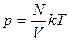 , но
, но 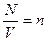 - число молекул газа в единице объема, отсюда
- число молекул газа в единице объема, отсюда 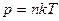 .
.
Отношение массы газа к объему дает плотность газа 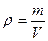 . Согласно (2), получаем
. Согласно (2), получаем
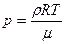 .
.
Существуют процессы, в ходе которых кроме уравнения состояния газ подчиняется некоторому дополнительному условию, определяющему характер процесса. Дополнительное условие может заключаться в том, что один из параметров состояния идеального газа может оставаться неизменным.
Если m,T = const, то pV = const (изотермический процесс),
если m,V=const, то 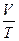 = const (изобарный процесс),
= const (изобарный процесс),
если m,V=const, то 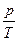 = const (изохорный процесс).
= const (изохорный процесс).
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 464; Нарушение авторских прав?; Мы поможем в написании вашей работы!