
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зонная теория кристаллов
|
|
|
|
Металлическая связь
Химия металлов
Металлы отличаются от других веществ высокой электрической проводимостью и теплопроводностью. В обычных условиях они – кристаллические вещества (исключая ртуть) с высокими координационными числами.
Специфику металлической связи рассмотрим на примере лития. Литий кристаллизуется в объемно-центрированной кубической решетке. У каждого атома восемь соседей, и поэтому литий должен предоставить 8 электронов для образования связи. Это невозможно, так как у него всего один электрон на внешнем энергетическом уровне (2 s 1). Как объяснить природу связи в кристалле лития? Каждый атом предоставляет 4 орбитали (1 s -орбиталь и 3 р -орбитали) и 1 электрон. Таким образом, число электронов намного меньше числа орбиталей. Поэтому электроны могут свободно переходить с одной орбитали на другую и принимать участие в образовании связи между всеми атомами. Так как энергия ионизации у металлов низкая, то валентные электроны слабо удерживаются в атоме, то есть легко перемещаются по всему кристаллу. Связь в металлах, таким образом, сильно делокализована. Свободные электроны, перемещающиеся по кристаллу, называют «электронным газом». Именно поэтому металлы имеют блеск, они обычно серого цвета и непрозрачны.
Делокализация связи в кристаллах металлов является причиной следующих их свойств:
– пластичность – это способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы;
– электропроводность объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т. к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа»;
– теплопроводность обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла.
Для описания связи в кристаллах используют зонную теорию кристаллов (ЗТК).
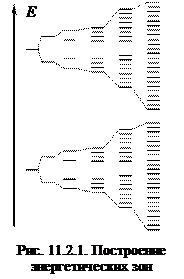 ЗТК рассматривает твердое тело как единый коллектив. Согласно теории химической связи каждое энергетическое состояние расщепляется на два – связывающее и разрыхляющее (2 атома – 2 состояния). Чем больше атомов, тем больше состояний. Пусть из N атомов состоит кристалл (рис. 11.2.1), тогда существует N состояний. Так как N велико, то энергетические уровни сближаются, образуя энергетическую зону. Изменение энергетических состояний в пределах зоны составляет 10–22 эВ. Это очень маленькая величина, и поэтому изменение энергии электронов в зоне можно представить как непрерывную полосу энергии. Орбитали энергетической зоны простираются по всему кристаллу.
ЗТК рассматривает твердое тело как единый коллектив. Согласно теории химической связи каждое энергетическое состояние расщепляется на два – связывающее и разрыхляющее (2 атома – 2 состояния). Чем больше атомов, тем больше состояний. Пусть из N атомов состоит кристалл (рис. 11.2.1), тогда существует N состояний. Так как N велико, то энергетические уровни сближаются, образуя энергетическую зону. Изменение энергетических состояний в пределах зоны составляет 10–22 эВ. Это очень маленькая величина, и поэтому изменение энергии электронов в зоне можно представить как непрерывную полосу энергии. Орбитали энергетической зоны простираются по всему кристаллу.
Предположим, что атомы расположены друг от друга на большом расстоянии (r) (больше, чем в реальном кристалле).

При сближении атомов атомные орбитали объединяются в энергетические зоны (рис. 11.2.2). Ширина и положение зоны зависит от величины r. Максимально возможное число электронов в зоне для s -, p -, d - и f -орбиталей составляет соответственно 2 N, 6 N, 10 N и 14 N.
Зона, которую занимают электроны, осуществляющие связь, называется валентной зоной. Свободная зона, расположенная энергетически выше валентной зоны, называется зоной проводимости. Валентная зона и зона проводимости могут перекрываться и не перекрываться. Если они не перекрываются, то между ними образуется запрещенная зона. При ширине запрещенной зоны (Δ Е) более 3 эВ материал является диэлектриком, при Δ Е от 0,1 до 3 эВ – полупроводником, а при отсутствии запрещенной зоны – проводником.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1463; Нарушение авторских прав?; Мы поможем в написании вашей работы!