
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение электронных оболочек атомов
|
|
|
|
Состояние электрона в многоэлектронных атомах всегда отвечает закону, сформулированному Паули: в атоме не может быть даже двух электронов, обладающих одинаковым набором всех четырех квантовых чисел. Это говорит о том, что на атомной орбитале может находится не более двух электронов.
Электронная оболочка имеет упорядоченное строение. Она состоит из электронных уровней (слоев), число которых равно номеру периода. В соответствии с принципом Паули максимальное число электронов на энергетическом уровне равно 2n2.
Каждый уровень, кроме первого, делится на подуровни. Число подуровней равно номеру уровня, максимальное число электронов на подуровне-2(2l +1).
Чем выше расположен уровень, тем больше энергия его электронов.
Наименьшей энергией обладают электроны первого уровня а наибольшей -внешнего уровня. Наиболее устойчиво состояние атома, в котором электроны имеют наименьшую энергию.
Заполнение электронной оболочки происходит в соответствии с тремя правилами:
1. Заполнение электронной оболочки происходит в порядке возрастания энергии уровней (принцип наименьших энергий).
2. Заполнение подуровней происходит в соответствии с правилом Клечковского:
- электроны заполняют тот подуровень для которого сумма значений главного и орбитального квантовых числе наименьшая;
- если сумма значений главного и орбитального квантовых чисел одинакова, то электроны заполняют тот подуровень для которого меньше значение главного квантового числа.
Отсюда следует следующий порядок заполнения уровней и подуровней: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
3. Порядок заполнения атомных орбиталей происходит в соответствии с правилом Хунда: электроны заполняют атомные орбитали таким образом чтобы спин был максимальным.
Например:
+15 Р 1s2 2s2 2p6 3s2 3p3
+25 Mn 1s2 2s2 2p6 3s2 3p3 3d5 4s2
Приведённые формулы называются полными электронными формулами элемента. В зависимости от того электроны какого подуровня заполняются у данного элемента, они делятся на s-,p-,d-, f- элементы.
К s-элементам относятся элементы главных подгрупп первой и второй групп, р-элементы - это элементы главных подгрупп всех остальных групп. К d-элементам относятся элементы побочных подгрупп, а к f-элементам - лантаноиды и актиноиды.
Обычно используют сокращённые электронные формулы, содержащие только электроны валентного уровня, число которых равно номеру группы. (для элементов главных подгрупп валентными являются электроны последнего энергетического уровня, для элементов побочных подгрупп последнего s и предпоследнего d).
Эти формулы используют для определения валентных возможностей атома. Их легко составить, зная период и группу атома. Например, бром-это элемент четвертого периода седьмой группы главной подгруппы, поэтому его сокращенная электронная формула: +35Вr...4s2 4p 5; ванадий элемент четвертого периода пятой группы побочной подгрупп: +23V …3d3 4s2
2. Электронно-графические формулы
Эти схемы используют для определения валентных возможностей
атома. Уровни и подуровни должны располагаться в соответствии с их энергией: чем выше подуровень, тем выше его располагают. Орбитали изоб-ражают квадратиком или черточкой.




 Например: Е 3d
Например: Е 3d



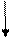
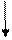 17Cl...3s2 3p5
17Cl...3s2 3p5

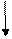
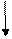



 3p
3p
3s
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 418; Нарушение авторских прав?; Мы поможем в написании вашей работы!