
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Выпадение неорганических кристаллических осадков цз попутно добываемой воды
|
|
|
|
Разработка многих нефтяных и газовых месторождений серьезно осложнена выпадением неорганических солей из попутно извлекаемой воды в нефтепромысловом оборудовании и на различных участках пласта.
Основные компоненты в большинстве отложений: карбонат кальция (СаСО3), сульфат кальция (гипс CaSO4×2H2O и ангидрит CaSO4), сульфат бария (BaSO4).
В значительных количествах в составе отложений имеются различные примеси: сульфат стронция (SrSO4), карбонат стронция (SгСО3), карбонат бария
(ВаСО3), карбонат магния(MgCO3), хлорид натрия, сульфат paдия. Встречаются механические примеси, продукты коррозии (окислы железа Fе2О3, сульфид железа FeS2) и др. В призабойной зоне нагнетательных скважин в составе неорганических осадков часто встречаются продукты жизнедеятельности бактерий.
Отложения чистых сульфатных или углекислых солей встречаются редко. Обычно они представлены смесью основного неорганического компонента с частицами нефти, силикатов, парафина, продуктами коррозии, примесями других солей (табл. V.1).
Таблицa V.I - Состав солевых отложений, отобранных с поверхностей различных нефтепромысловых объектов
Большинство отложений имеет кристаллическую структуру. Процесс их формирования представляет собой массовую кристаллизацию в сложных гидродинамических условиях, в широком интервале температур и пересыщений раствора солями в присутствии большого количества примесей, способных оказывать существенное влияние на характер (свойства) кристаллических осадков.
Образование кристаллических неорганических солей как процесс состоит из ряда основных, этапов: пересыщение раствора солями; зародышеобразование; рост кристаллов; перекристаллизация..
Эти этапы могут протекать либо поочередно один за другим, либо одновременно.
Пересыщение раствора солями относительно какого-либо компонента связано с увеличением концентрации последнего выше равновесной (растворимости). Условием возникновения этого процесса на нефтяных и газовых месторождениях является наличие минерализованной попутно добываемой воды и причин, вызывающих ее пересыщение. В водах многих нефтяных месторождений растворено большое количество неорганических солей (табл. V.2).
Таблица V.2 – Физико-химические свойства пластовых, попутно добываемых и закачиваемых вод (по данным КазНИПИНефть)
Данные опытов показывают, что закачиваемая (морская) и пластовые воды месторождений Узень и Жетыбай химически не совместимы. При их смешивании образуется пересыщенный раствор.
Несовместимость закачиваемых вод с пластовыми — одна из главных причин солеотложений на большинстве нефтяных месторождений. Однако образование осадков часто наблюдается до начала заводнения пластов. Значит, помимо названной причины образования пересыщенных растворов существуют и другие. Остановимся на них подробнее.
1. Изменение термодинамических условий. При этом возможно образование карбонатов кальция по схемам
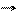
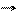
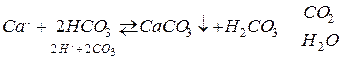 (V. 15)
(V. 15)
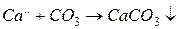
В пластовых водах |НСО3| >> |СО3|, и образование СаСО3 происходит в основном по схеме (V.15).
В отличие от большинства неорганических солей кальцит лучше растворяется в воде с уменьшением температуры. Если при 100 °С его равновесная концентрация составляет 14 мг/л, то при О°С — 85 мг/л.
Однако с уменьшением давления и температуры из раствора выпадает осадок СаСО3, ибо на направление реакции по схеме (V.15) в значительно большей степени, чем температура влияет парциальное давление углекислого газа. Влияние парциального давления СО2 на растворимость NСаСО3 в воде дано ниже.
| Парциальное давление СО2, МПа | 0,0001 | 0,01 | 0,1 | 1,0 |
| Растворимость N, мг/л |
Изменение давления и температуры способно привести к пересыщению растворов относительно сульфатов кальция и бария (табл. V.3).
Таблица V.3 Влияние температуры на растворимость сульфатов кальция и бария в воде
Максимальная растворимость гипса наблюдается при температуре 40 °С. При дальнейшем повышении температуры гипс становится менее растворимым, а растворимость ангидрита уменьшается намного быстрее. Поэтому в скважинах и пластах с температурой выше 40 °С возможно преобладание в отложениях ангидрита.
На растворимость барита температура оказывает незначительное влияние.
Зависимость равновесных концентраций сульфатов кальция и бария от давления незначительна. Так, при падении давления от 50,0 МПа до 10 МПа при температуре 100 °С растворимость сульфата кальция уменьшается на 0,04 % по массе и составляет 0,09 %• Влияние давления на растворимость сульфата кальция в насыщенном растворе при 20 °С приведено ниже.
| Растворимость N, мг/л | 2,08 | 2,12 | 2,33 | 2,46 |
| Давление, МПа | 0,1 | 4,1 | 10,1 | 16,1 |
Оно невелико, однако анализ промысловых и лабораторных данных показывает, что уменьшение давления может привести к выпадению сульфатов бария и кальция из раствора.
Понижение давления вызывает испарение части воды в газовую фазу, что также способствует пересыщению водно-солевых систем.
2. Изменение химического состава пластовых вод в процессе разработки месторождений. Смешение закачиваемой и пластовой вод даже при условии их химической совместимости приводит зачастую к формированию попутно добываемой воды совершенно нового состава по сравнению с пластовой. А это, в свою очередь, способствует изменению растворимости отдельных компонентов. В табл. V.4 показано влияние содержания NaCl на растворимость СаСО3, CaSO4 и BaSO4 в дистиллированной воде. При высокой концентрации хлористого натрия в растворе заметно повышается растворимость СаСО3 и CaSO4 (растворимость кальцита максимальна при содержании NaCl в количестве 120 г/л, а гипса — 150 г/л). В большей степени (в 10 раз) повышается при этом растворимость BaSO4.
Таблица V.4 Влияние содержания хлористого натрия на растворимость некоторых солей в воде
Пластовые воды месторождений, разработка которых осложнена солеотложениями, являются водами хлоркальциевого типа. В таких водах растворимость гипса, например, невелика. Если при отсутствии в воде хлористого кальция равновесная концентрация гипса в ней составляет 2080 мг/л, то при содержании в растворе 367,85 г/л CaCl2 она уменьшается до 32 мг/л. Влияние содержания G хлористого кальция СаС12 на растворимость N сульфата кальция приведено ниже.
| G, г/л | 367,85 | 280,30 | 192,91 | 97,02 | 51,53 | 32,05 | 25,77 | 11,96 | 7,49 | |
| N, мг/л |
В табл. V.5 приведены данные, характеризующие растворимость системы CaSO4 —СаСО3 в воде.
Табл ица V.5 - Растворимость системы CaSO4 — CaCO3 в воде (твердая фаза системы — СаСО3)
Итак, в двухкомпонентных системах различные соли по-разному влияют на равновесную концентрацию основных компонентов неорганических осадков.
Реальные пластовые, закачиваемые и попутно добываемые воды — многокомпонентные водно-солевые системы. Какова же растворимость солей в таких системах?
Приведенные в табл. V.6 и V.7 значения растворимости ангидрита и гипса интерполированы по опытным данным для шести различных концентраций раствора. Вода, подвергавшаяся разбавлению и концентрированию, имела следующий первоначальный состав (в массовых долях, %): Na× —0,9114, К× — 0,0315; Mg××— 0,1059, Са×× —0,340, С1'—1,629, SO"4 — 0,2283, S = 2,940. Зависимость растворимости ангидрита и гипса от суммарной минерализации и от массовой доли, отдельных компонентов носит сложный характер и изменяется в широких пределах. При увеличении доли Сl' до 4 % для большинства значений температур растворимость сульфата кальция возрастает. При дальнейшем повышении содержания ионов хлора в системе уменьшается равновесная концентрация сульфата кальция.
Таблица V.6 - Растворимость ангидрита (CaSO4) в многокомпонентной водно-солевой системе
Таблица V.7 - Растворимость гипса (CaSO4×2Н2О) в многокомпонентной водно-солевой системе (r — плотность в г/см3)
Таким образом, изменение минерализации попутно добываемой воды может привести к ее пересыщению.
3. Поступление на забой скважины вод разных горизонтов. При эксплуатации Майкопского газоконденсатного месторождения, например, из-за некачественного цементирования скважин и значительной разницы в давлениях газ и воды перетекали из одного горизонта в другой. Смешение щелочных вод I и II горизонтов, содержащих большое количество СаС12 и MgCl2, с водами III горизонта приводило к образованию солевых осадков за счет протекания следующих химических реакций:
2NaHCO3 + СаС12 = СаСО3¯+ 2NaCl + Н2О + СО2, (V. 16)
2NaHCO3 + MgCl2 = MgCO3¯ + 2NaCl + H2O+CO2. (V.17)
4. Тепловые методы разработки. При этих методах разработки нефтяных месторождений в процессе закачки воды в залежи, находящиеся на больших глубинах, при высоких температурах возможно частичное или полное растворение воды в нефти.
Во ВНИИнефти исследованы особенности фазовых равновесий в системе вода — Н-гексадекан.
Н-гексадекан имеет высокую температуру кипения (286,8 °С) и большой молекулярный вес (226,4), поэтому он рассматривался в качестве аналога нефти. Результаты исследований приведены в табл. V.8.
Таблица V.8 - Характеристики трехфазного равновесия в системе н-гексадекан — вода
Существуют и другие факторы, способствующие возникновению солеотложений — выщелачивание солей, содержащихся в пласте, процессы обогащения закачиваемых вод солями при контакте их с погребенными водами, повышение растворимости воды в нефти с увеличением температуры (т. е. в условиях нефтяных месторождений углеводороды, отвлекая на себя часть воды, могут служить высаливателями.
Следует отметить, что в связи со сложным механизмом солеотложений в промысловых объектах методы прогнозирования его недостаточно обоснованы. Некоторые процессы не поддаются учету (адсорбция), другие постоянно изменяются и неоднозначно влияют на механизм солеотложения, третьи — мало изучены (влияние поверхности оборудования, гидродинамические эффекты, влияние органических компонентов нефти и т. д.). Поэтому на практике для борьбы с солеотложениями значительно реже используют меры предупреждения, чем методы удаления их различными средствами. При отложениях солей карбонатов, с помощью соляной кислоты хорошо удаляются карбонаты кальция и магния.
Для борьбы с рыхлыми отложениями гипса в начальный период загипсовывания оборудования используются 10—15%-ные растворы карбоната и бикарбоната натрия и калия. При этом гипс преобразуется в карбонат кальция, который затем удаляют соляной кислотой.
Для удаления плотных, плохо проницаемых осадков применяют более эффективные растворы: гидроокиси натрия и калия, 20%-ный раствор каустической соды (техническое название едкого натрия). Предложены многие другие составы реагентов, удаляющих солеотложения.
Глава VI МОЛЕКУЛЯРНО-ПОВЕРХНОСТНЫЕ СВОЙСТВА СИСТЕМЫ НЕФТЬ—ГАЗ—ВОДА—ПОРОДА
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 2984; Нарушение авторских прав?; Мы поможем в написании вашей работы!