
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз. Пример 1. Составьте уравнения электродных процессов, протекающих при электролизе водного раствора Bi2(SO4)3 в электролизерах: а) с угольными электродами; б) с
|
|
|
|
Пример 1. Составьте уравнения электродных процессов, протекающих при электролизе водного раствора Bi2(SO4)3 в электролизерах: а) с угольными электродами; б) с висмутовыми электродами.
Для каждого варианта вычислите массы веществ, полученных (или растворенных) на электродах, если через электролизеры пропущен ток силой 10,0 А в течение 1 ч 10 мин. Для газообразных веществ определите их объем при н.у.
Решение. а) На катоде в первую очередь протекает восстановление наиболее сильных окислителей, характеризующихся бόльшим потенциалом. К отрицательно заряженному катоду движется катионы Bi3+, которые могут восстанавливаться до металлического висмута ( + 0,22 В) и полярные молекулы воды, которые могут восстанавливаться до водорода (
+ 0,22 В) и полярные молекулы воды, которые могут восстанавливаться до водорода ( = 0,00 В при pH 0;
= 0,00 В при pH 0;  = –0,41 В при pH 7). Поскольку
= –0,41 В при pH 7). Поскольку  >
>  , то на катоде восстанавливается висмут:
, то на катоде восстанавливается висмут:
Bi3+ + 3  = Bi
= Bi
К положительно заряженному аноду движутся анионы  и полярные молекулы воды. В сульфат-ионе сера находится в высшей степени окисления (+6), поэтому дальнейшее окисление серы невозможно. В данных условиях протекает единственно возможный процесс – окисление воды до кислорода:
и полярные молекулы воды. В сульфат-ионе сера находится в высшей степени окисления (+6), поэтому дальнейшее окисление серы невозможно. В данных условиях протекает единственно возможный процесс – окисление воды до кислорода:
2H2O – 4  = O2 + 4H+
= O2 + 4H+
По законам Фарадея масса восстановленного на катоде висмута:
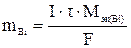 , (1)
, (1)
где 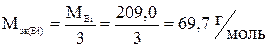 ;
;
I – сила тока, А;
τ – продолжительность электролиза, с;
F – константа Фарадея, 96 500 Кл.
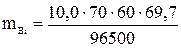 = 30,3 г.
= 30,3 г.
Масса выделившегося на аноде кислорода:
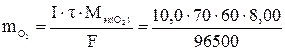 = 3,48 г,
= 3,48 г,
где 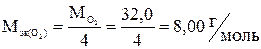 .
.
Объем, занимаемый газом при н.у., определяется по формуле:
 ,
,
где n – количество газа, моль;
m – масса газа, г;
M – молярная масса газа,  ;
;
V0 = 22,4 л – объем одного моль газа при н.у.
Для кислорода
 = 2,44 л.
= 2,44 л.
б) На висмутовом аноде кроме окисления воды возможно окисление висмута – материала анода. На аноде протекает, в первую очередь, окисление наиболее сильных восстановителей, характеризующихся меньшим потенциалом. Поскольку  = +0,22В <
= +0,22В < 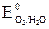 = +1,23В, то окисляться будет материал анода:
= +1,23В, то окисляться будет материал анода:
Bi – 3  = Bi3+
= Bi3+
На катоде, как и в варианте (а), восстанавливается висмут:
Bi3+ + 3  = Bi
= Bi
Массы осажденного на катоде и растворенного на аноде висмута одинаковы и определяются уравнением (1): на катоде из раствора восстановилось 30,3 г висмута и столько же висмута растворилось на аноде.
Пример 2. При электролизе водных растворов AgNO3 и NiSO4 в двух электролизерах, соединенных последовательно, на катодах выделилось соответственно серебро массой 5,39 г и никель массой 1,39 г. Определите выход по току никеля, если выход по току серебра 100%. Какова продолжительность электролиза при силе тока 5,00 А?
Решение. Если на электроде возможно одновременно протекание нескольких процессов, то используют понятие выхода по току. Выходом по току i-го вещества (Bi) называется доля общего количества электричества в процентах, которая расходуется на окисление или восстановление i-го вещества при электролизе
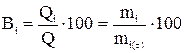 ,
,
где Q = I·τ – общее количество прошедшего электричества;
Qi – количество электричества, израсходованное на окисление или восстановление i-го вещества;
mi – масса i-го вещества, окисленного или восстановленного на электроде;
mi(τ) – то же, теоретически рассчитанное из предположения 100%-ного выхода по току.
Из законов Фарадея по массе выделившегося серебра при 100%-ном выходе по току определим продолжительность электролиза τ:
 = 964 с = 16 мин 4 с.
= 964 с = 16 мин 4 с.
Рассчитаем массу никеля, которая выделилась бы при 100%-ном выходе по току
 = 1,47 г.
= 1,47 г.
Выход по току никеля
 = 94,6%.
= 94,6%.
Пример 3. В течение какого времени следует проводить электролиз при силе тока 8,00А для выделения на катоде всей меди, содержащейся в 250 мл 0,100 М раствора CuSO4?
Решение. Из законов Фарадея
 ,
,
или
 , (2)
, (2)
где nэк(Cu) – количество моль эквивалентов меди.
Количество моль меди в растворе
nCu = cV = 0,100·0,250 = 0,0250 моль,
где c – молярная концентрация CuSO4, 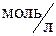 ;
;
V – объем раствора, л.
Поскольку эквивалент меди ЭCu = ½ Cu, то nэк(Cu) = 2nCu =
= 2·0,0250 = 0,0500 моль. Подставим значение nэк(Cu) в уравнение (2):
 = 603 c = 10 мин 3 с.
= 603 c = 10 мин 3 с.
Задания
161-168. Электролиз водного раствора вещества X проводили с угольными электродами катодного и анодного процессов. Вычислите массы веществ, выделившихся на катоде и на аноде. Определите объем выделившихся газообразных веществ (н.у.).
| Номер задачи | X | I, A | τ |
| CuSO4 | 15,0 | 5 ч 37 мин | |
| K2SO4 | 10,0 | 30 мин | |
| NaOH | 25,0 | 30 мин | |
| AgNO3 | 10,1 | 1 ч 40 мин | |
| KI | 10,0 | 50 мин | |
| NaBr | 18,0 | 1 ч 40 мин | |
| Al2(SO4)3 | 20,0 | 45 мин | |
| H2SO4 | 15,0 | 25 мин |
169-175. Электролиз водного раствора вещества X проводили с анодом из материала Y при силе тока I. Составьте уравнения электродных процессов. Определите, сколько потребуется времени для окисления на аноде массы mA соответствующего вещества. Составьте уравнения электродных процессов с угольным анодом.
| Номер задачи | X | Y | mA, г | I, A |
| NiSO4 | Ag | 15,0 | 10,0 | |
| AgNO | Ag | 100,0 | 20,0 | |
| SnCl2 | Sn | 45,0 | 15,0 | |
| Na2SO4 | Cd | 50,0 | 25,0 | |
| Номер Задачи | X | Y | mA, г | I, A |
| MgCl2 | Mg | 15,0 | 15,0 | |
| H2SO4 | Cu | 65,0 | 30,0 | |
| CdSO4 | Cd | 60,0 | 10,0 |
176. При электролизе водных растворов KI и CuSO4 в двух электролизерах, соединенных последовательно, масса одного из катодов увеличилась на 15,7 г. Какое количество электричества было пропущено через электролизеры? Составьте уравнения катодных и анодных процессов в каждом из электролизеров, если электроды угольные.
177. Через два соединенных последовательно электролизера, содержащих, соответственно, водные растворы Na2SO4 и AgNO3, пропускали ток силой 10,0 А в течение 1 ч 40 мин. На какую величину увеличилась масса одного из электродов? Составьте уравнения всех катодных и анодных процессов, если электроды угольные.
178. Составьте уравнения процессов, протекающих на угольных электродах при электролизе: а) водного раствора MgCl2; б) расплава MgCl2. Вычислите массу веществ, выделяющихся на электродах в том и другом случаях, если через раствор и расплав пропустили ток силой 20,0 А в течение 1 ч 20 мин. Определите объем выделяющихся газов (н.у.).
179. Составьте электронные уравнения процессов, происходящих на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом; с растворимым серебряным анодом. Вычислите массу серебра и объем кислорода, выделившихся на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом, если время
180. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов MgSO4 и ZnCl2. Вычислите силу тока при электролизе раствора MgSO4 в течение 1 ч 40 мин, если на катоды выделилось 1,4 л водорода (н.у.).
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 3198; Нарушение авторских прав?; Мы поможем в написании вашей работы!