
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика и химическое равновесие
|
|
|
|
Химическая кинетика – раздел химии, изучающий скорость и механизм химических реакций. Различают гомогенные и гетерогенные химические реакции.
Гомогенные реакции протекают в объеме одной фазы – в жидком (водном) или газовом растворе. Например, 2СО(г) + О2(г) = 2СО2(г) (8)
Гетерогенные реакции протекают на границе раздела фаз: г – ж, г – т,
т – т и т.д. Например, 2С(т) + О2(г) = 2СО(г) (9)
Скорость химической реакции (υ ) – это изменение количества вещества одного из реагентов за единицу времени в единице реакционного пространства. Она зависит от природы реагирующих веществ, температуры (Т), давления (Р), концентрации (С) реагирующих веществ и других факторов. Зависимость υ от С выражается законом действующих масс: При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Например, для гомогенной реакции (8) υ = k∙С2СО ×СО2, где k – константа скорости химической реакции, которая зависит от природы реагирующих веществ, температуры, присутствия катализатора, но не зависит от концентрации реагирующих веществ; С – молярные концентрации веществ (моль / л). Для гетерогенной реакции (9) υ = k×СО2 , так как концентрации твердых веществ постоянны и приняты равными единице, т.е. СС = 1.
Зависимость скорости химической реакции от температуры выражает правило Вант-Гоффа: при повышении температуры на каждые 10º скорость химической реакции увеличивается примерно в 2 – 4 раза. Математическое выражение закона Вант-Гоффа:

 , (10)
, (10)
где υТ1 и υТ2 – скорости реакции при температурах Т1 и Т2; γ - температурный коэффициент скорости химической реакции. Он показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10º.
По полноте протекания химических процессов различают необратимые и обратимые химические реакции. Необратимые реакции протекают только в одном направлении и завершаются полным превращением исходных веществ в продукты реакции. Обратимые реакции при одной и той же температуре протекают как в прямом, так и в обратном направлении и завершаются установлением в системе химического равновесия. Они не идут до конца, в системе всегда остаются исходные вещества:
N2(г) + 3H2(г) ⇄ 2NH3(г) (11)
Химическое равновесие – такое состояние химического взаимодействия, при котором скорости прямой и обратной реакций равны между собой, т.е.  .
.
После наступления состояния равновесия концентрации реагирующих веществ при данных условиях остаются неизменными и называются равновесными концентрациями, обозначаются в квадратных скобках [ ]. Количественной характеристикой химического равновесия является константа химического равновесия К – величина, определяемая соотношением равновесных концентраций продуктов реакции и исходных веществ.Если в соотношение для константы равновесия входят равновесные концентрации, то ее обозначают символом Кс, а если используются парциальные давления газов (Рi), то – символом Кр. Например, для реакции (11):
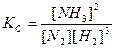 ,
, 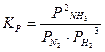
Состояние химического равновесия устанавливается и сохраняется лишь при определенных условиях (температуре, давлении и концентрации реагирующих веществ). При изменении хотя бы одного из этих условий, т.е. при каком-либо внешнем воздействии, равновесие в системе нарушается, и система переходит в новое состояние равновесия. Этот переход называется смещением химического равновесия.
Влияние внешних воздействий (изменение Т, Р или С) на состояние химического равновесия можно предсказать, пользуясь принципом Ле Шателье - Брауна: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия, т.е на внешнее воздействие система отвечает противодействием. Так увеличение концентрации какого-либо вещества вызовет противодействие системы – стремление уменьшить концентрацию этого вещества, что возможно путем смещения равновесия в направлении, при котором концентрация этого вещества будет уменьшаться.
Повышение Робщ или Рi; приводит к смещению равновесия в сторону протекания той реакции, которая вызывает уменьшение Робщ и Рi и наоборот, понижение Робщ или Pj смещает равновесие в направлении той реакции, которая приводит к увеличению этих параметров.
Повышение температуры вызывает смещение равновесия в направлении протекания той реакции, которая сопровождается поглощением теплоты, т.е. эндотермической (∆Н > 0). Понижение температуры будет вызывать смещение равновесия в сторону экзотермической реакции, сопровождающееся выделением теплоты (∆Н < 0).
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 730; Нарушение авторских прав?; Мы поможем в написании вашей работы!