
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Пример 1. Алюминий находится в контакте с цинком
|
|
|
|
Пример 1. Алюминий находится в контакте с цинком. Какой из этих металлов будет окисляться, если эта пара попадет в кислую среду, например, в среду соляной кислоты?
Р е ш е н и е. Из условия задачи следует что металлы находятся в кислой среде – растворе HCl. Раствор HCl – электролит, т.е. электропроводящая среда, следовательно, будет протекать электрохимическая коррозия. Для рассмотрения механизма коррозии воспользуемся предложенным выше алгоритмом.
1) Составим схему коррозионной гальванопары:
Al │ HCl │ Zn
2) Укажем окислитель. Среда кислая, поэтому окислителем (деполяризатором) является ион водорода H+. Следовательно, в этой схеме будет протекать электрохимическая коррозия с водородной деполяризацией.
3) Определим, какой из металлов будет являться анодом, а какой – катодом. Для этого сравним значения стандартных электродных потенциалов алюминия и цинка:
Е0Al3+/Al0= – 1,6 B < E0Zn2+/Zn0= – 0,77 B,
Значит, алюминий – более активный металл, он является восстановителем и анодом, а цинк – катодом: Al – анод (А), Zn – катод (К).
4) Укажем направление движения электронов, учитывая, что электроны движутся от анода к катоду, а от катода – к окислителю окружающей среды:

(-) Al│HCl│Zn(+)
5) Запишем электронные уравнения процессов, протекающих на электродах, и составим суммарное уравнение:
 (–)(A) Al0 – 3e– → Al3+ 2
(–)(A) Al0 – 3e– → Al3+ 2
(+)(K) 2Н+ + 2е– → Н2↑ 3
2Al0 +6H+ → 2Al3+ + 3H2↑
6) Составим молекулярное уравнение окислительно-восстановительной реакции, протекающей при коррозии: 2Al + 6HCl → 2AlCl3 + 3H2↑
7) Запишем вывод: при коррозии алюминия, находящегося в контакте с цинком, окисляется алюминий. Продуктом его коррозии является соль – хлорид алюминия. На цинковом катоде выделяется водород.
Пример 2. Изделие из меди с оловянным покрытием находится во влажном воздухе. Какой из металлов будет корродировать при нарушении целостности покрытия? К какому типу покрытий относится в этом случае олово?
Р е ш е н и е. Изделие находится во влажном воздухе, который является электропроводящей средой, следовательно, будет протекать электрохимическая коррозия.
1) Составим схему коррозионного гальванического элемента:
Sn │ H2O │ Cu
2) Укажем окислитель. Вода – это нейтральная среда, поэтому окислителем (деполяризатором) является кислород – О2. Следовательно, в этой схеме будет протекать электрохимическая коррозия с кислородной деполяризацией.
3) Определим, какой из металлов будет являться анодом, а какой – катодом. Для этого сравним значения стандартных электродных потенциалов олова и меди:
Е0Sn 2+/ Sn0= – 0,14 B < E0Cu2+/Cu0= + 0,34 B.
Значит, олово – более активный металл, оно является восстановителем и анодом, а медь – катодом: Sn – анод (А), Cu – катод (К).
4) Укажем направление движения электронов, учитывая, что электроны движутся от анода к катоду, а от катода – к окислителю среды:

(–) Sn │H2O │ Cu (+)
5) Запишем электронные уравнения процессов, протекающих на электродах, и составим суммарное уравнение. При написании уравнения катодного процесса следует учитывать, что процесс восстановления протекает в присутствии воды:
 (-)(A) Sn0 – 2e– → Sn2+ 2
(-)(A) Sn0 – 2e– → Sn2+ 2
(+)(K) O2 + 2H2O + 4е– →4OН– 1
2Sn0 +2O2 + 2H2O → 2Sn2+ +4OH–
6) Составим молекулярное уравнение окислительно-восстановительной реакции, протекающей при коррозии: 2Sn0 +2O2 + 2H2O → 2 Sn(OH)2
7) Запишем вывод: по отношению к меди олово является анодным покрытием, так как в этой паре олово выступает в роли анода. При нарушении целостности покрытия корродировать будет олово. Продуктом его коррозии является основание – гидроксид олова.
Пример 3. Медная деталь разрушается в атмосфере кислорода при температуре 2000С. В чем заключается причина этого явления?
Р е ш е н и е. 1) Определяем характер среды: атмосфера кислорода (О2) при высокой температуре (2000С) – это неэлектропроводящая среда. Следовательно, будет происходить химическая коррозия.
2) Запишем уравнение процесса, протекающего при химической коррозии медной детали:
 Cu0 + O20 = 2CuO
Cu0 + O20 = 2CuO
Вывод: происходит окисление меди и на поверхности детали образуется оксидная пленка.
1.14. Электролиз
Электролиз – это совокупность окислительно-восстановительных процессов, протекающих на электродах при пропускании постоянного электрического тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую энергию.
Электролиз проводят в электролизере, который представляет собой емкость, заполненную раствором или расплавом электролита, в который погружены два электрода (например, графитовые) – катод и анод. Катод подсоединяют к отрицательному полюсу внешнего источника тока, а анод – к положительному. Таким образом, катод – отрицательно заряженный электрод, а анод – положительно заряженный электрод. На катоде происходит процесс присоединения электронов катода (от внешнего источника тока) катионами, атомами, молекулами. На аноде происходит процесс отдачи электронов аноду (во внешнюю цепь) анионами, атомами, молекулами. Таким образом, на катоде протекает процесс восстановления, на аноде – процесс окисления.
Рассмотрим механизм электролиза на примере расплава соли фторида натрия NaF. Расплавы солей являются сильными электролитами, поэтому при высоких температурах полностью диссоциируют на ионы в соответствии с уравнением процесса: NaF = Na+ + F. –
Под действием электрического тока ионы приобретают направленное движение: катионы будут двигаться к катоду, а анионы – к аноду. Достигнув электродов, ионы начнут разряжаться на их поверхности. На катоде будет происходить процесс  восстановления ионов Na+, а на аноде – процесс окисления ионов F–. Запишем электронные уравнения этих процессов и просуммируем их:
восстановления ионов Na+, а на аноде – процесс окисления ионов F–. Запишем электронные уравнения этих процессов и просуммируем их:
(К–): Na+ + e– → Na0 2 – процесс восстановления
(A+): 2F- – 2e– → F2 1 – процесс окисления
2Na+ + 2F- → Na0 + F2↑
Суммарное молекулярное уравнение электролиза:
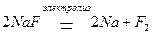
Электролиз водных растворов электролитов осложняется участием в электродных процессах молекул воды. Алгоритм рассмотрения электролиза водных растворов солей приведен в примерах решения задач.
При электролизе водных растворов электролитов необходимо учитывать особенности катодных и анодных процессов:
1. Катионы металлов от Li+ до Al3+ включительно (Е0Меn+/Ме0 < – 1,66 В) не восстанавливаются на катоде, вместо них на катоде восстанавливаются молекулы воды в соответствии с уравнением реакции: 2Н2О + 2е– = Н2 + 2ОН–
2. Катионы металлов от Mn2+ до H, восстанавливаются на катоде вместе с молекулами воды: Меn+ + ne– = Me0; 2Н2О + 2е– = Н2 + 2ОН–
3. Катионы металлов от Cu2+ до Au3+ полностью восстанавливаются на катоде в соответствии с уравнением реакции: Меn+ + ne– Me0
Если водный раствор электролита содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения значений стандартных электродных потенциалов металлов.
4. На практике используют два типа анодов: инертные или нерастворимые (уголь, графит, золото, платина) и активные или растворимые (Cu, Ag, Ni, Zn и др). Инертные электроды не участвуют в процессе электролиза. Активные аноды сами участвуют (окисляются) в процессе электролиза в соответствии с уравнением реакции: Ме0 – ne– = Men+.
5. Анионы кислородсодержащих кислот (SO42-, NO3-, CO32-, PO43 -), в которых центральный атом (S+6, N+5, C+4, P+5).находится в высшей степени окисления, а также ионы F– никогда не окисляется на аноде из водных растворов электролитов. Вместо них окисляются молекулы воды: 2Н2О – 4е– = О20 + 4Н+
Количественные соотношения между массой выделившихся на электродах веществ и количеством прошедшего электричества через раствор или расплав электролита выражают законом Фарадея:
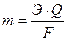 , (32)
, (32)
где m – масса вещества, выделившегося на электроде;
Э – его химический эквивалент;
Q – количество электричества (Кл);
F – число Фарадея (F= 96500 Кл).
Q = I·t, где I – сила тока (А), t – время электролиза (с).
Э=А/n, где А – атомная масса элемента; n – степень окисления его в соединении.
Тогда выражение (31) примет вид:
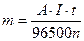 (33)
(33)
При электролизе в реальных условиях масса выделившегося вещества (его практический выход) всегда меньше массы вещества, рассчитанной по закону Фарадея. Это объясняется тем, что наряду с основными электродными процессами протекают побочные процессы, на которые расходуется часть количества электричества. Поэтому вводится понятие «выход по току»:
Впт =mпр/mтеор×100%, (33)
где mпр – масса вещества, практически полученного в процессе электролиза;
mтеор - масса вещества, теоретически рассчитанная по закону Фарадея.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 3814; Нарушение авторских прав?; Мы поможем в написании вашей работы!