
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Состав атомных ядер
|
|
|
|
В настоящее время твердо установлено, что атомные ядра различных элементов состоят из двух частиц – протонов и нейтронов.
По современным измерениям, положительный заряд протона в точности равен элементарному заряду e = 1,60217733·10–19 Кл, то есть, равен по модулю отрицательному заряду электрона. В настоящее время равенство зарядов протона и электрона проверено с точностью 10–22. Такое совпадение зарядов двух непохожих друг на друга частиц вызывает удивление и остается одной из фундаментальных загадок современной физики. Масса протона, по современным измерениям, равна mp = 1,67262·10–27 кг. В ядерной физике массу частицы часто выражают в атомных единицах массы (а. е. м.), равной 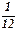 массы атома углерода с массовым числом 12:
массы атома углерода с массовым числом 12:
1 а. е. м. = 1,66057·10–27 кг.
Обозначение протона – 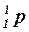 или
или 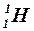
Следовательно,
mp = 1,007276 · а. е. м.
Во многих случаях массу частицы удобно выражать в эквивалентных значениях энергии в соответствии с формулой:
E = mc2.
Так как 1 эВ = 1,60218·10–19 Дж, в энергетических единицах масса протона равна 938,272331 МэВ.
Таким образом, в опыте Резерфорда было открыто явление расщепления ядер азота и других элементов при ударах быстрых α-частиц и показано, что протоны входят в состав ядер атомов.
В 1920 г. Резерфорд высказал гипотезу о существовании в составе ядер жестко связанной компактной протон-электронной пары, представляющей собой электрически нейтральное образование – частицу с массой, приблизительно равной массе протона. Он даже придумал название этой гипотетической частице – нейтрон.
Нейтрон – это элементарная частица. Ее не следует представлять в виде компактной протон-электронной пары, как первоначально предполагал Резерфорд.
По современным измерениям, масса нейтрона mn = 1,67493·10–27 кг = 1,008665 а. е. м. В энергетических единицах масса нейтрона равна 939,56563 МэВ. Масса нейтрона приблизительно на две электронные массы превосходит массу протона.
Обозначение нейтрона: 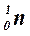 .
.
Сразу же после открытия нейтрона российский ученый Д. Д. Иваненко и немецкий физик В. Гейзенберг выдвинули гипотезу о протонно-нейтронном строении атомных ядер, которая полностью подтвердилась последующими исследованиями. Протоны и нейтроны принято называть нуклонами.
Для характеристики атомных ядер вводится ряд обозначений. Число протонов, входящих в состав атомного ядра, обозначают символом Z и называют зарядовым числом или атомным номером (это порядковый номер в периодической таблице Менделеева). Заряд ядра равен Ze, где e – элементарный заряд. Число нейтронов обозначают символом N.
Общее число нуклонов (то есть протонов и нейтронов) называют массовым числом A:
A = Z + N.
Ядра химических элементов обозначают символом 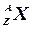 , где X – химический символ элемента. Например,
, где X – химический символ элемента. Например,
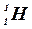 – водород,
– водород,
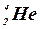 – гелий,
– гелий,
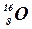 – кислород,
– кислород,
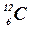 – углерод,
– углерод,
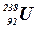 – уран.
– уран.
Ядра одного и того же химического элемента могут отличаться числом нейтронов. Такие ядра называются изотопами. У большинства химических элементов имеется несколько изотопов. Например, у водорода три изотопа:
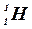 – обычный водород,
– обычный водород,
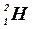 – дейтерий,
– дейтерий,
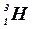 – тритий.
– тритий.
У углерода – 6 изотопов, у кислорода – 3.
Химические элементы в природных условиях обычно представляют собой смесь изотопов. Присутствие изотопов определяет значение атомной массы природного элемента в периодической таблице Менделеева. Так, например, относительная атомная масса природного углерода равна 12,011.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 507; Нарушение авторских прав?; Мы поможем в написании вашей работы!