
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Таким образом, состояние электрона в атоме можно описать с помощью четырех квантовых чисел: n, l, me и ms
|
|
|
|
Магнитное квантовое число mе характеризует пространственное расположение орбиталей относительно некоторого фиксированного направления. Магнитное квантовое число зависит от орбитального квантового числа и принимает значения от (–l до +l).
Соотношения между значениями 1 и mе для различных подуровней следующие:
| n | ||||
| S | p | D | F | |
| l | ||||
| mе | -1, 0, +1 | -2, -1, 0, +1, +2 | -3, -2, -1, 0, +1, +2, +3 |
Следовательно, s-орбиталь не ориентирована в пространстве и ее граничной поверхностью является сфера, р-орбитали ориентированы в трех направлениях (px, py, pz) и каждая имеет вид замкнутой гантелеобразной поверхности. d- и f-орбитали имеют более сложную форму.
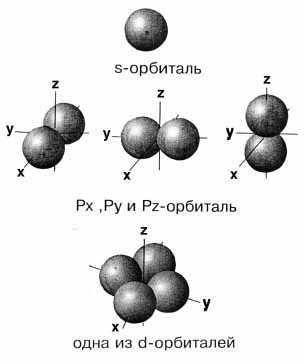
Рис. 2.1. Модели атомных орбиталей
Кроме орбитального механического момента 1, электрон обладает собственным или врожденным механическим моментом S. Этот момент называется спином (В. Паули, 1924г.) Спин электрона возникает за счет вращения его вокруг собственной оси. По аналогии с орбитальным квантовым числом 1 вводится спиновое квантовое число ms. Спиновое магнитное число может принимать только два значения: + ½ и – ½. Состояния электрона с ms = ½ часто называют «спин вверх», и с ms = - ½ - «спин вниз». Обычно эти состояния электрона условно обозначают стрелкой, направленной вверх или вниз ↑ ↓.
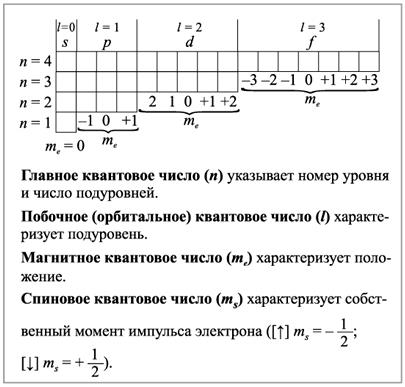
Рис.2.2.Значение квантовых чисел элементов по периодам
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 658; Нарушение авторских прав?; Мы поможем в написании вашей работы!