
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атома. Рис. 85 Атом (с греческого неделимый) – это мельчайшая частица вещества, строение которой впервые было установлено Э.Резерфордом
|
|
|
|
 Рис. 85
Рис. 85
|
Модель атома имела ряд недостатков:
1) Атом должен быть неустойчивым, так как электроны, двигаясь вокруг ядра, теряют энергию, и радиус их орбиты уменьшается. В итоге электрон должен упасть на ядро. В действительности этого не происходит.
2) Потеря энергии электроном должна давать непрерывный спектр излучения. В действительности спектры излучения линейчатые.
Ядерная модель атома Резерфорда была усовершенствована Нильсом Бором. Его модель основана на постулатах:
Постулат стационарных состояний: Существуют некоторые стационарные состояния атома, находясь в которых он не излучает энергии.
Постулат, называемый правилом частот: при переходе атома из стационарного состояния в возбужденное поглощается энергия. При возвращении атома из возбужденного состояния в стационарное энергия излучается (рис. 86).
| Рис 86 | 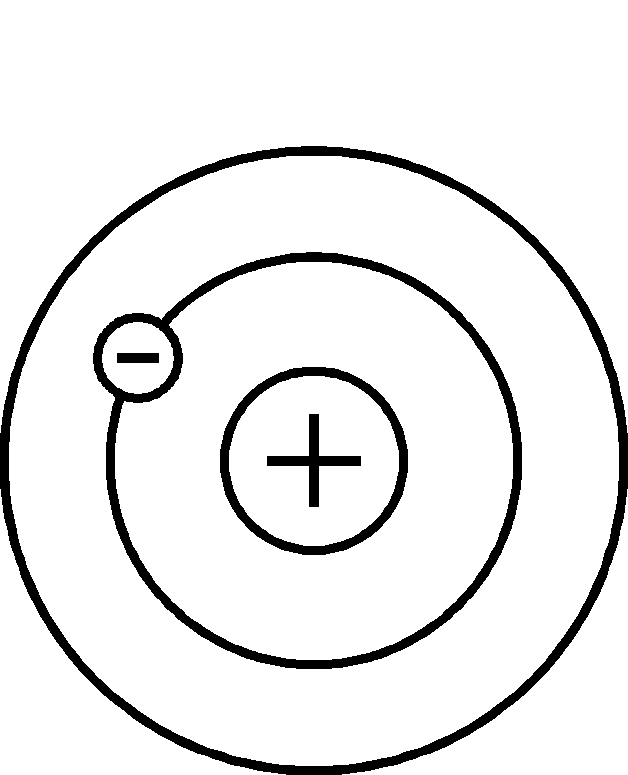
| 
| 
|
| стационарное состояние | возбужденное состояние | возвращение в стационарное состояние |
hν – поглощаемая или излучаемая энергия.
Если энергия атома в двух состояниях соответственно Wn и Wm, то
│ Wm – Wn │= Δ W = hν.
Если Δ W > 0– поглощение кванта.
Если Δ W < 0– излучение кванта.
Теория Н. Бора сыграла огромную роль в развитии атомной физики, точно указав направление ее развития.
Дальнейшие исследования в области атомной и ядерной физики позволили установить строение атомного ядра. Важнейшими характеристиками ядра являются его заряд Z и масса М. Заряд ядра определяется количеством положительных элементарных зарядов, сосредоточенных в ядре. Носителем положительного заряда в ядре является протон. Его заряд 1,6·10–19 Кл. Так как атом нейтрален, то заряд ядра определяет количество электронов в атоме. Распределение электронов происходит по энергетическим оболочкам, и зависит от их общего количества. То есть заряд ядра определяет распределение и состояние электронов в атоме, в частности, число электронов на внешней оболочке, от которого зависят химические свойства атома.
Масса ядра А практически совпадает с массой атома. Массы атомов измеряют в атомных единицах массы. В 1932 году был открыт нейтрон, обладающий массой, близкой к массе протона, но не имеющий электрического заряда. Д.Д. Иваненко сформулировал гипотезу о протонно-нейтронном строении ядра, по которой заряд ядра Z определяет число протонов, а разность А – Z = N – дает число нейтронов.
При измерении масс атомов оказалось, что атомы данного химического элемента, обладающие одинаковым зарядом, отличаются массой. Это изотопы. В ядрах изотопов отличается количество нейтронов. Количество протонов одинаково.
Протоны и нейтроны, входящие в состав атомного ядра, получили общее название – нуклоны.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1078; Нарушение авторских прав?; Мы поможем в написании вашей работы!