
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Биосинтез, локализация, влияние факторов на накопление производных антрацена в растениях
|
|
|
|
Биосинтез антраценпроизводных происходит по общему пути образования фенольных соединений. В 60-е годы XX в. Берч и Донован выдвинули ацетатную теорию биосинтеза производных антрацена, согласно которой в растениях происходит конденсация ацетатных остатков с последующей их циклизацией. Позднее эта версия была подтверждена методом меченых атомов.
В настоящее время установлено, что существует 2 пути образования производных антрацена в растениях:
· По ацетатно-малонатному пути образуются антраценпроизводные в грибах и лишайниках и производные хризацина в растениях.
· По смешанному пути происходит образование производных ализарина и эмодинов в растениях.
В растениях гликозиды производных антрацена находятся в растворенном виде в клеточном соке, а агликоны – в виде кристаллических включений; локализуются преимущественно в основной ткани: паренхиме коры, сердцевине и сердцевинных лучах. Накопление антраценпроизводных происходит в листьях, побегах, траве, плодах, подземных органах, коре. Содержание их в растениях колеблется от 2 % до 6 %.
В растениях антраценпроизводные встречаются как в свободном состоянии, так и в виде гликозидов. Чаще образуют О-гликозиды, реже - С-гликозиды (барбалоин из листьев алоэ древовидного). В качестве сахарного компонента могут выступать глюкоза, рамноза, арабиноза, ксилоза. В зависимости от количества и места присоединения сахарных остатков, антраценпроизводные делят на монозиды, биозиды и дигликозиды. Наиболее часто в образовании гликозидов участвуют ОН-группы в положениях 1, 3, 6, 8.
На накопление антраценпроизводных влияют условия внешней среды, возраст и фаза развития растения:
1. Установлено, что максимальное содержание производных антрацена в подземных органах наблюдается на второй, третий или четвертый год жизни, после чего их содержание снижается.
2. В ходе вегетативного развития растений происходит изменение в качественном и количественном отношении: осенью преимущественно накапливаются гликозиды антрахинонов, а летом и весной - свободные агликоны; в молодых растениях (в начале вегетации) преобладают восстановленные формы, а в старых (к концу вегетационного периода) - окисленные. Так, в листьях сенны, траве зверобоя максимальное содержание производных антрацена наблюдается в период цветения.
Данные закономерности указывают на активное участие производных антрацена в окислительно-восстановительных процессах. Это свойство необходимо учитывать при заготовке и применении сырья крушины. Собранная весной кора крушины содержит преимущественно восстановленные формы производных антрацена, которые при использовании вызывают тошноту и рвоту. Поэтому кору крушины перед применением выдерживают в течение 1 года при обычных условиях хранения или в течение 1 часа при 100-105 °С в сушильном шкафу. При этом происходит окисление восстановленных форм производных антрацена.
Классификация антраценпроизводных
Природные производные антрацена образуют компактную группу соединений с незначительным разнообразием в строении углеродного скелета. В качестве заместителей в составе этих соединений обычно встречаются: гидроксильные (-ОН), метоксильные (-ОСН3), метильные (-СН3), гидроксиметильные (-СН2ОН), альдегидные (-СНО), карбоксильные (-СООН) и другие функциональные группы.
В основу классификации антраценпроизводных положены:
· структура и степень окисленности углеродного скелета;
· характер, количество и расположение заместителей.
В зависимости от структуры углеродного скелета, природные производные антрацена делят на 3 основные группы:
I. Мономерные соединения (содержат 1 ядро антрацена);
II. Димерные соединения (содержат 2 ядра антрацена);
III. Конденсированные соединения (содержат 2 ядра и более).
I. Мономерные соединения в зависимости от степени окисленности среднего кольца В делят на две группы:
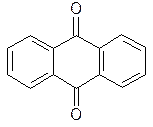
1) окисленные (9,10-антрахинон и его производные);
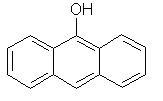
2) восстановленные (антрон, оксиантрон, антранол и их производные).
| 
| 
|
| 9,10-Антрахинон | Антрон | Антранол |
Окисленные антраценпроизводные – антрахиноны, в зависимости от положения гидроксилъных (-ОН) групп, делят на две подгруппы:
1) Ализарин и его производные. Обнаружены в растениях семейств Rubiaceae, Scrophulariaceae.
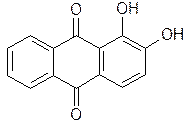
| 
|
| Ализарин (1,2-дигидроксиантрахинон) | Кислота рубэритриновая (2-ксилозилглюкозид ализарина) |
Ализарин и его гликозид – кислота рубэритриновая являются основными действующими веществами подземных органов марены красильной.
2) Хризацин и его производные. Обнаружены в растениях семейств Rhamnaceae, Polygonaceae, Asphodelaceae, Fabaceae.

|
| Хризофанол (3-метилхризацин) |
Встречается в коре крушины ольховидной, плодах жостера слабительного, корнях ревеня тангутского и щавеля конского.

|
| Эмодин (3-метил-6-гидроксихризацин) |
Является одним из представителей группы эмодинов - веществ, производных 1,8-дигидроксиантрахинона, которые содержат в своем составе 3 и более гидроксильных групп. Эмодины имеют сходное строение. В зависимости от растительного источника отличаются стереоструктурой и названием:
- реумэмодин (Rheum palmatum var. tanguticum, Rumex confertus);
- франгулаэмодин (Frangula alnus, Rhamnus cathartica);
- франгулин - 6-рамнозид франгулаэмодина (Frangula alnus, Rhamnus cathartica);
- глюкофрангулин - 6-рамноглюкозид франгулаэмодина (Frangula alnus, Rhamnus cathartica);
- алоээмодин - 3-оксиметил-хризацин (Aloë arborescens);
- реин - 3-карбоксихризацин (Cassia acutifolia).
II. Димерные соединения.
Встречаются окисленные и восстановленные соединения. Молекулы димерных антраценпроизводных могут состоять из одинаковых (симметричные) или различных мономеров (несимметричные), связанных по кольцу В в гамма -положениях. Обнаружены в растениях семейств Fabaceae, Rhamnaceae.
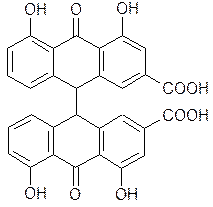
| симметричные (диреин-антрон) диантрон реина |
Сеннидины А и В (стереоизомеры диреин-антрона) содержатся в листьях сенны.

| несимметричные (франгуларозид) |
III. Конденсированные соединения.
Состоят из двух мономеров антрахинонов, соединенных по альфа - и гамма -положениям. Обладают фотосенсибилизирующим действием. Обнаружены в растениях семейства Hypericaceae.

|
| Гиперицин (содержится в траве зверобоя) |
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 479; Нарушение авторских прав?; Мы поможем в написании вашей работы!