
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порядок выполнения работы. 1. В стакан М налить дистиллированную воду так, чтобы ее уровень коснулся кончика капилляра
|
|
|
|
1. В стакан М налить дистиллированную воду так, чтобы ее уровень коснулся кончика капилляра.
2. Открыть кран Е настолько незначительно, чтобы уровень в колене А манометра поднимался очень медленно. Максимальный уровень в колене А зафиксировать указателем N в наивысшем положении. Далее, следя за уровнем манометрической жидкости в колене В, определить разность уровней h жидкости в коленах А и В.
Опыт повторить не менее пяти раз. Данные занести в таблицу.
3. По формуле (5) для каждого наблюдения определить радиус капилляра r и найти его среднюю величину.
4. Определить абсолютную погрешность < Dr> результата измерений из формулы относительной погрешности для косвенных измерений:
 ,
,
где < r >– среднее значение радиуса r капилляра.
Таблица
| № опыта | h, м | r, кг/м3 | s, Н/м | r, м | < r >,м | D r, м | < D r>, м |
Указания к работе
1. Плотность манометрической жидкости (подкрашенной воды) принять равной 1·103 кг/м3.
2. Коэффициент поверхностного натяжения воды (в стакане М) определить из графика зависимости его величины от температуры.
3. Величину D h принять равной 0,5·10-3 м.
Контрольные вопросы
1. Что называется силой поверхностного натяжения, коэффициентом поверхностно-
го натяжения?
2. Какие силы действуют на жидкость в капиллярной трубке и как они направлены?
3. От чего зависит дополнительное давление в капилляре? Какова формула допол-
нительного давления?
4. Вывести формулу (5) для определения радиуса капилляра.
5. Почему кончик капилляра не должен быть погружен в жидкость в процессе вы-
полнения работы, а должен касаться его поверхности?
Литература
1. Трофимова Т.И. Курс физики. М.: Академия, 2008. – 560 с. § 66-69.
2. Грабовский Р.И. Курс физики. СПб.: Лань. 2005. -608 с. Ч. I, § 61-63.
ПРИЛОЖЕНИЕ
ГРЕЧЕСКИЙ АЛФАВИТ
| 1. A a - альфа | 9. I i - йота | 17. R r - ро |
| 2. B b - бета | 10. K k - каппа | 18. S s - сигма |
| 3. G g - гамма | 11. L l - ламбда | 19. T t - тау |
| 4. D d - дельта | 12. M m - мю | 20. U u - ипсилон |
| 5. E e - эпсилон | 13. N n - ню | 21. F j - фи |
| 6. Z z - дзета | 14. X x - кси | 22. C c - хи |
| 7. H h - эта | 15. O o - омикрон | 23. Y y - пси |
| 8. Q q - тэта | 16. P p - пи | 24. W w - омега |
ЛАТИНСКИЙ АЛФАВИТ
| 1. A a - а | 10. J j - йот, жи | 19. S s - эс |
| 2. B b - бе | 11. K k - ка | 20. T t - тэ |
| 3. C c - це | 12. L l - эль | 21. U u - у |
| 4. D d - де | 13. M m - эм | 22. V v - ве |
| 5. E e - е | 14. N n - эн | 23. W w - дубль-ве |
| 6. F f - эф | 15. O o - о | 24. X x - икс |
| 7. G g - ге, же | 16. P p - рэ | 25. Y y - игрек |
| 8. H h - ха, аш | 17. Q q - ку | 26. Z z - зет |
| 9. I i - и | 18. R r - эр |
ДОЛЬНЫЕ И КРАТНЫЕ ЕДИНИЦЫ СИ
| Приставка | Числовое значение | Обозначение | Приставка | Числовое значение | Обозначение |
| Атто | 10-18 | а | Дека | 101 | да |
| Фемто | 10-15 | ф | Гекто | 102 | г |
| Пико | 10-12 | п | Кило | 103 | к |
| Нано | 10-9 | н | Мега | 106 | М |
| Микро | 10-6 | мк | Гига | 109 | Г |
| Милли | 10-3 | м | Тера | 1012 | Т |
| Санти | 10-2 | с | Пета | 1015 | П |
| Деци | 10-1 | д | Экса | 1018 | Э |
Нормальные условия: давление р 0= 1 атм = 101325 Па; температура t 0= 0 0С.
Внесистемные единицы давления:
1 мм рт. ст.= 133,32 Па = 1 тор
1 мм. водного столба = 9,81 Па
1 бар = 105 Па
Физическая атмосфера 1 атм = 760 мм рт. ст.= 101325 Па
Техническая атмосфера 1 ат = 1  = 9806,65 Па
= 9806,65 Па
Таблица 1. Фундаментальные физические постоянные
| Постоянная | Числовое значение |
| Гравитационная постоянная | G = 6,6720 ∙10-11 Н∙м2·кг-2 |
| Нормальное ускорение свободного падения | g = 9,80665 м/с2 |
| Скорость света в вакууме | с = 2,9979 ∙108 м/с» 3∙108 м/с |
| Универсальная газовая постоянная | R= NA∙kБ = 8,3144 Дж∙моль-1∙К-1 |
| Постоянная Авогадро | N А = 6,022∙1023 моль-1 |
| Постоянная Больцмана | k Б = R/NA = 1,3807∙10-23 Дж/К |
| Молярный объем идеального газа при нормальных условиях (р 0 =1 атм, t0 = 0 0С) | V μ = 22,41 ∙10-3 м3∙моль-1 |
| Атомная единица массы | а.е.м. = 1,6606 ∙10-27 кг |
| Постоянная Планка | h = 6,626 ∙10-34 Дж∙с |
| Магнитная постоянная | m 0 = 4p ∙10-7 Гн/м |
| Электрическая постоянная | e 0 = 8,85 ∙10-12 Ф/м |
| Заряд электрона | 1,6022∙10-19 Кл |
| Масса покоя электрона | 9,1095∙10-31 кг |
| Масса покоя протона | 1,6726∙10-27 кг |
| Масса покоя нейтрона | 1,67495∙10-27 кг |
Таблица 2. Астрономические постоянные
| Постоянная | Числовое значение |
| Астрономическая единица (среднее расстояние Земли от Солнца) | 1,49597870∙1011 м |
| Радиус Солнца | 6,9599 ∙108 м |
| Масса Солнца | 1,989 ∙1030 кг |
| Масса Земли | 5,976 ∙1024 кг |
| Радиус Земли экваториальный полярный средний | 6378164 м 6356799 м 6371030 м |
| Напряженность магнитного поля Земли на магнитных полюсах на магнитном экваторе | 55,7 А/м 33,4 А/м |
| Масса Луны | 7,35 ∙1022 кг |
| Среднее расстояние между Землей и Луной | 3,8440 ∙107 м |
| Состав атмосферы Земли в % (по объему/по массе) | |
| азот N2 | 78,09/75,60 |
| кислород O2 | 20,95/23,05 |
| аргон Ar | 0,93/1,3 |
| двуокись углерода CO2 | 0,03/0,047 |
| неон Ne | 0,00187/8,4∙10-4 |
Таблица 3. Ускорение свободного падения g для разных широт на уровне моря, м/с2
| Нормальное | 9,80665 | 300 | 9,79321 | 590 57¢ (С-Пб) | 9,81908 |
| На полюсе | 9,83235 | 400 | 9,80166 | 600 | 9,81914 |
| На экваторе | 9,78049 | 4502¢32¢¢ (Краснодар) | 9,80612 | 700 | 9,82606 |
| 100 | 9,78030 | 500 | 9,81066 | 800 | 9,83058 |
| 200 | 9,78634 | 55045¢(Москва) | 9,81523 | 900 | 9,83216 |
Таблица 4. Модули Юнга твердых веществ
| Вещество | Е, 1011 Па | Вещество | Е, 1011 Па |
| Сталь легированная | 2,10 – 2,20 | Свинец | 0,17 |
| Сталь углеродная | 2,00 – 2,10 | Золото | 0,79 |
| Железо | 2,00 | Чугун серый | 1,15 – 1,50 |
| Медь | 1,10 | Бетон | 30,00 |
| Алюминий | 0,70 | Стекло | 0,56 |
Таблица 5. Плотность газов и паров при нормальных условиях (р 0 = 1 атм, t 0 = 0 0С)
| Вещество | ρ, кг/м3 | Вещество | ρ, кг/м3 |
| Азот | 1,2505 | Озон | 2,144 |
| Аммиак | 0,77146 | Окись углерода (СО) | 1,2504 |
| Аргон | 1,7830 | Пропан | 2,02 |
| Водород | 0,08988 | Сероводород (пар) | 1,5362 |
| Водяной пар насыщенный (при 100 0С) | 0,589 | Спирт метиловый (пар) | 1,426 |
| Воздух сухой (при 0 0С) | 1,2928 | Спирт этиловый (пар) | 2,043 |
| Воздух сухой (при 20 0С) | 1,205 | Фтор | 1,696 |
| Гелий | 0,17846 | Хлор | 3,214 |
| Двуокись углерода (СО2) | 1,9769 | Хлороформ | 5,639 |
| Кислород | 1,42895 | Этан | 1,357 |
| Метан | 0,7168 | Этилен | 1,2604 |
Таблица 6. Плотность жидкостей при р 0 = 1 атм, t 0 = 20 0С
| Жидкость | ρ, 103 кг/м3 | Жидкость | ρ, 103 кг/м3 |
| Ацетон | 0,792 | Масло креозот | 1,04 - 1,10 |
| Бензин | 0,68 - 0,72 | Масло машинное | 0,90 - 0,92 |
| Бензол | 0,879 | Масло оливковое | 0,92 |
| Вода | 0,99823 | Масло смазочное | 0,90 - 0,92 |
| Вода (дистиллиров., 4 0С) | 1,000 | Масло парафиновое | 0,87 - 0,88 |
| Жидкость | ρ, 103 кг/м3 | Жидкость | ρ, 103 кг/м3 |
| Глицерин | 1,26 | Масло скипидарное | 0,87 |
| Керосин | 0,79-0,82 | Нефть | 0,81 - 0,85 |
| Масло вазелиновое | 0,8 | Ртуть | 13,55 |
| Масло касторовое | 0,96 | Спирт этиловый | 0,7893 |
Таблица 7. Плотность элементов и сплавов при р 0 = 1 атм, t 0 = 20 0С
| Элемент или сплав | ρ, 103 кг/м3 | Элемент или сплав | ρ, 103 кг/м3 |
| Алюминий | 2,70 | Платина | 21,37 |
| Олово | 7,29 | Свинец | 11,34 |
| Вольфрам | 19,3 | Серебро | 10,5 |
| Железо (чистое) | 7,87 | Золото | 19,3 |
| Железо (чугун) | 6,6 - 7,3 | Углерод (алмаз) | 3,52 |
| Железо (сталь) | 7,7 - 7,9 | Углерод (графит) | 2,25 |
| Кремний аморфный | 2,35 | Латунь | 8,4 - 8,7 |
| Кремний кристаллический | 2,42 | Бронза | 8,7 - 8,9 |
| Цинк | 7,1 | Константан | 8,88 |
| Медь | 8,89 | Дуралюмин | 2,7 – 2,9 |
Таблица 8. Плотность твердых веществ при р 0 = 1 атм, t 0 = 20 0С
| Вещество | ρ, 103 кг/м3 | Вещество | ρ, 103 кг/м3 |
| Асбест | 2,0 - 2,8 | Мел | 1,9 - 2,8 |
| Бетон | 2,3 | Парафин | 0,82 - 0,91 |
| Бумага | 0,7 - 1,2 | Пластмасса | 1,1 - 2,4 |
| Глина | 1,8 - 2,6 | Пробка | 0,22 - 0,26 |
| Графит | 0,9 - 2,3 | Резина | 0,91 - 0,93 |
| Деготь, смола | 1,02 | Слюда обычная | 2,6 - 3,2 |
| Картон | 0,69 | Стекло обыкновенное | 2,4 - 2,8 |
| Каучук | 0,92 - 0,96 | Фарфор | 2,20 - 2,50 |
| Кварц плавленый | 2,66 | Целлулоид | 1,4 |
| Соль поваренная | 1,10 – 1,35 | Дуб | 0,76 |
| Лед (при 0 0С) | 0,917 | Клен | 0,75 |
| Горох | 1,30 – 1,50 | Береза | 0,65 |
| Кукуруза (зерно) | 1,30 | Липа | 0,45 |
| Овес | 1,20 – 1,40 | Сосна | 0,52 |
| Рожь | 1,20 – 1,50 | Дерево бальза | 0,10-0,12 |
Таблица 9. Некоторые постоянные газов (при р 0 = 1 атм): вязкость η (при 150С),
удельная теплоемкость ср (при 200С), 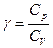 (при 20 0С)
(при 20 0С)
| Вещество | Формула | η, 10-6 Па∙с | ср, 103 Дж/(кг∙К) | 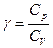
|
| Азот | N2 | 17,4 | 1,051 | 1,40 |
| Аммиак | NH3 | 9,70 | 2,244 | 1,31 |
| Водород | Н2 | 8,71 | 14,269 | 1,41 |
| Водяной пар | Н2О | 9,26 | 2,0112) | 1,3243) |
| Воздух | - | 17,90 | 1,009 | 1,40 |
| Гелий | Не | 19,43 | 5,296 | 1,66 |
| Закись азота | N2O | 14,61) | 0,913 | 1,27 |
| Кислород | О2 | 20,03 | 0,913 | 1,40 |
| Метан | СН4 | 10,77 | 2,483 | 1,31 |
| Неон | Ne | 31,21) | 1,038 | 1,68 |
| Окись азота | NO | 18,81) | 0,976 | 1,40 |
| Окись углерода | CO | 17,51) | 1,047 | 1,40 |
| Углекислый газ | CO2 | 14,48 | 0,837 | 1,30 |
1) η при 200С; 2) ср (Н2О) при 100-5000С; 3) γ при 1000С.
Таблица 10. Вязкость некоторых жидкостей при р 0 = 1 атм, t 0 = 20 0С
| Жидкость | η, 10-3 Па·с | Жидкость | η, 10-3 Па·с |
| Вода | 1,006 | Масло трансформаторное | 19,8 |
| Глицерин | Ртуть | 1,554 | |
| Масло касторовое | Спирт этиловый | 1,20 | |
| Масло машинное легкое | Керосин | 1,8 | |
| Масло машинное тяжелое | Бензин | 0,65 |
Таблица 11. Удельная теплоемкость жидкостей при t 0 = 20 0С
| Жидкость | с, Дж/(кг∙К) | Жидкость | с, Дж/(кг∙К) |
| Вода | Масло трансформаторное | ||
| Лед (0 0С) | Масло хлопковое | ||
| Глицерин | Спирт этиловый | ||
| Масло касторовое | Ртуть |
Таблица 12. Коэффициент поверхностного натяжения жидкостей при t 0 = 200С
| Жидкость | σ, 10-3 Н/м | Жидкость | σ, 10-3 Н/м |
| Ацетон | 23,7 | Масло касторовое | 33,1 |
| Бензин | 28,9 | Масло оливковое | 33,06 |
| Вода | 72,75 | Ртуть | |
| Глицерин | 63,4 | Спирт этиловый | 22,3 |
| Керосин | 24,0 | Спирт метиловый | 22,6 |
Таблица 13. Удельная теплота парообразования жидкостей и расплавленных метал-
лов при температуре кипения и нормальном атмосферном давлении
| Жидкость | t, 0С | r, кДж/кг | Металл | t, 0С | r, кДж/кг |
| Вода | Ртуть | 356,66 | |||
| Бензин автомобильный | 70 - 205 | 230 - 310 | Медь | ||
| Спирт этиловый | 78,3 | Железо | |||
| Воздух | -193 | Свинец | |||
| Гелий | -268,92 | Олово | |||
| Кислород | -182,962 | Магний | |||
| Водород | -252,87 | Алюминий |
Таблица 14. Показатели преломления веществ для длины волны 589 нм
(желтая линия)
| Вещество | n | Вещество | n |
| Газы и водяной пар (р 0 = 1 атм, t 0 = 0 0С) | Твердые тела (при t 0 = 20 0С) | ||
| Азот | 1,000298 | Алмаз | 2,42 |
| Водород | 1,000132 | Стекло | 1,5 – 1,9 |
| Водяной пар | 1,000255 | Янтарь | 1,55 |
| Воздух | 1,000292 | Каменная соль | 1,54 |
| Кислород | 1,000271 | Лед (в интервале 0-(-4) 0С) | 1,31 |
| Жидкости (при t 0 = 20 0С) | Рубин | 1,76 | |
| Ацетон | 1,36 | Сахар | 1,56 |
| Бензин | 1,38 – 1,41 | Натрий1) | 0,005 |
| Вода | 1,33 | Серебро1) | 0,18 |
| Глицерин | 1,47 | Золото1) | 0,37 |
| Спирт метиловый | 1,33 | Железо1) | 1,63 |
| Молоко | 1,35 – 1,36 | Медь1) | 2,06 |
1) - тончайшие металлические пленки
Таблица 15. Показатели преломления некоторых распространенных стекол
для разных длин волн при t 0 = 20 0С
| Сорт стекла | l = 6563 нм | l = 5893 нм | l = 4861 нм | l = 4340 нм |
| Боросиликатный крон | 1,5136 | 1,5160 | 1,5217 | 1,5262 |
| Плотный бариевый крон | 1,5852 | 1,5881 | 1,5949 | 1,6003 |
| Легкий флинт | 1,5746 | 1,5787 | 1,5888 | 1,5973 |
| Сверхплотный флинт | 1,6415 | 1,6469 | 1,6607 | 1,6724 |
Таблица 16. Интервалы длин волн и частот и соответствующие им цвета видимой
части спектра
| Цвет спектра | Длина волны, нм | Частота, ТГц |
| Красный | 760 – 620 | 395 – 483 |
| Оранжевый | 620 – 590 | 483 – 508 |
| Желтый | 590 – 560 | 508 – 536 |
| Зеленый | 560 – 500 | 536 – 600 |
| Голубой | 500 – 480 | 600 – 625 |
| Синий | 480 – 450 | 625 – 666 |
| Фиолетовый | 450 – 380 | 666 – 789 |
Таблица 17. Шкала электромагнитных излучений
| Название диапазона волн | Примерный диапазон длин волн, м | Диапазон частот, Гц |
| Низкочастотные электрические колебания | ¥ – 105 | 0 – 3·103 |
| Радиоволны | 105 – 10-3 | 3·103 – 3·1011 |
| Инфракрасное излучение | 2·10-3 – 7,6 ·10-7 | 1,5·1011– 4,0·1014 |
| Видимое излучение | 7,6 ·10-7 – 3,8 ·10-7 | 4,0·1014 – 8,0·1014 |
| Ультрафиолетовое излучение | 3,8 ·10-7 – 3 ·10-9 | 8,0·1014 – 1017 |
| Рентгеновское излучение | 10-8 – 10-12 | 3·1016 – 3·1020 |
| Гамма-излучение | 10-11 и менее | 3·1019 и выше |

КРАТКИЙ ФИЗИЧЕСКИЙ СЛОВАРЬ
Абсолютная температура (термодинамическая температура) – параметр состояния, характеризующий макроскопическую систему в состоянии термодинамического равновесия. Отсчитывается от абсолютного нуля температуры, который расположен на 273,15 0С ниже нуля температуры по шкале Цельсия.
Авогадро постоянная – число структурных элементов (атомов, молекул, ионов и др. частиц) в одном моле вещества.
Адиабатный процесс – процесс, происходящий без теплообмена с окружающей средой.
Адиабаты показатель – показатель степени в уравнении адиабатного процесса.
Атом – микрочастица, наименьшая часть химического элемента, являющаяся носителем его свойств.
Барометр – прибор для измерения атмосферного давления.
Больцмана постоянная – одна из фундаментальных физических констант, равна отношению газовой постоянной R к постоянной Авогадро N A.
Броуновское движение – хаотичное движение малых частиц, взвешенных в жидкости или газе, происходящее под действием молекул окружающей среды.
Вакуум – разреженный газ, в котором средняя длина свободного пробега больше размеров содержащего газ сосуда.
Вакуум физический – в квантовой теории поля низшее энергетическое состояние квантованных полей, характеризующееся отсутствием каких-либо реальных частиц.
Вероятность события – предел, к которому стремится отношение числа опытов, приводящих к его осуществлению, к общему числу опытов при беспредельном увеличении последних.
Если все события равновероятны, то вероятность равна отношению числа случаев, благоприятствующих его наступлению, к общему числу возможных случаев.
Вероятность термодинамическая - число способов (микросостояний), которыми может быть реализовано данное макросостояние физической системы.
Под макросостоянием понимается состояние газа, характеризуемое его давлением, температурой и объемом. Под микросостоянием понимается состояние газа, характеризуемое конкретным расположением и скоростями всех его частиц.
Вечный двигатель 1-го рода (перпетуум-мобиле) – воображаемый двигатель, который, будучи раз пущен в ход, совершал бы работу неограниченно долгое время, не заимствуя энергию извне.
Вечный двигатель 2-го рода - воображаемая периодически действующая машина, которая целиком превращала бы в работу теплоту, извлекаемую из окружающих тел.
Вещество – вид материи, обладающей массой покоя. В. Слагается из элементарных частиц, масса покоя которых не равна нулю (в основном из электронов, протонов и нейтронов).
Внутренняя энергия – энергия физической системы, зависящая от ее внутреннего состояния. В.э. включает в себя кинетическую энергию хаотического (теплового) движения всех микрочастиц системы (молекул, атомов, ионов и др.) и потенциальную энергию взаимодействия этих частиц.
Кинетическая энергия движения системы как целого и ее потенциальная энергия во внешних силовых полях во внутреннюю энергию не входят.
Второе начало термодинамики – один из основных законов термодинамики, устанавливает необратимость макроскопических процессов, протекающих с конечной скоростью: процессы, связанные с теплообменом при конечной разности температур, с трением, с диффузией, с выделением джоулевой теплоты и др., текущими с конечной скоростью, необратимы, т.е. могут самопроизвольно протекать только в одном направлении.
Вязкость (внутреннее трение) – свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой.
Газ – агрегатное состояние вещества, в котором его частицы слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объем.
Газ идеальный – газ, обладающий такими же свойствами, как и совокупность невзаимодействующих на расстоянии материальных точек, но сталкивающихся упруго, как шары.
Газ реальный – газ, в котором существуют силы взаимодействия между частицами (молекулами, атомами, электронами и др.), имеющими объем.
Давление газа – свойство газа оказывать воздействие на стенки содержащего его сосуда. Характеризует интенсивность перпендикулярных к поверхности сил, с которыми одно тело действует на поверхность другого.
Диффузия – взаимное проникновение соприкасающихся веществ друг в друга вследствие теплового движения частиц вещества. Д. относится к явлениям переноса, происходит при наличии градиента плотности в системе и приводит к выравниванию его плотности.
Длина свободного пробега – средняя длина пути, проходимого частицей между двумя последовательными столкновениями с другими частицами.
Жидкие кристаллы – особое состояние некоторых органических веществ, в котором они обладают свойствами жидкости – текучестью, но сохраняют определенную упорядоченность в расположении молекул и анизотропию ряда физических свойств, характерную для твердых кристаллов.
Жидкость – агрегатное состояние вещества, промежуточное между твердым и газообразным. В жидкостях энергия межмолекулярного взаимодействия сравнима с кинетической энергией молекул. Главные особенности: текучесть, от твердого тела - способность сохранять объем, существование свободной поверхности, определенная прочность на разрыв, от газа - принимает форму сосуда, может непрерывно переходить в газ.
Изопроцессы – процессы в газах, при которых один из трех параметров газа - давление, объем, температура, остается постоянным.
Испарение - переход вещества из жидкого или твердого агрегатного состояния в газообразное (пар).
Калориметр – прибор для измерения количества теплоты, выделяющейся или поглощающейся в к.-л. Физическом, химическом или биологическом процессе.
Калория – внесистемная единица измерения количества теплоты; 1 кал = 4,1868 Дж.
Капиллярные явления – явления, обусловленные поверхностным натяжением на границе раздела несмешивающихся сред – двух разных жидкостей, жидкости - газа или жидкости – пара, приводящие к искривлению поверхности раздела.
Искривление поверхности раздела ведет к появлению составляющей силы поверхностного натяжения, направленной внутрь объема одной из контактирующих фаз и возникновению дополнительного капиллярного давления, связанного со средней кривизной поверхности раздела.
Карно цикл – обратимый круговой процесс, в котором совершается превращение теплоты в работу (или наоборот), состоит из последовательно чередующихся двух изотермических и двух адиабатических процессов, осуществляемых с рабочим телом.
Карно теорема (франц. физик Н.Л.С. Карно, 1824): КПД цикла Карно максимален и не зависит от природы рабочего вещества и конструкции идеального теплового двигателя, он определяется только температурами нагревателя и холодильника.
Кипение – переход жидкости в пар (фазовый переход I рода), происходящий с образованием в объеме жидкости пузырьков пара или заполненных паром полостей на нагреваемых поверхностях.
Колебания кристаллической решетки – один из основных видов внутренних движений твердого тела, когда составляющие его структурные частицы (атомы, ионы, молекулы) колеблются около положений равновесия – узлов кристаллической решетки. Амплитуда колебаний тем выше, чем выше температура, но всегда существенно меньше, чем постоянные решетки. Когда амплитуда достигает некоторого критического значения, кристаллическая структура разрушается, начинается процесс плавления.
Кристаллическая решетка – присущее кристаллическому состоянию вещества регулярное расположение частиц (атомов, ионов, молекул), характеризующееся периодической повторяемостью в трех измерениях.
Конвекция – перенос теплоты в газах, жидкостях или сыпучих телах потоками вещества.
Конденсация – переход вещества вследствие его охлаждения или сжатия из газообразного состояния в конденсированное (жидкое или твердое).
Круговой процесс (цикл) – термодинамический процесс, при котором система, претерпев ряд изменений, возвращается в исходное состояние. Др. словами цикл – это процесс, начало и конец которого совпадают.
Цикл изображается на диаграмме процессов замкнутой кривой. Работа цикла определяется площадью, ограниченной прямой, изображающей цикл. Цикл, осуществляющийся по часовой стрелке, называется прямым, его работа больше нуля – система сама совершает работу; против час. стрелки – обратным, его работа меньше нуля, работа совершается над системой.
Ло¢шмидта постоянная – число молекул в 1 см3 вещества, находящегося в состоянии идеального газа при нормальных условиях.
Максвелла распределение – распределение по скоростям молекул (частиц) макроскопической системы, находящейся в статистическом равновесии, при условии, что движение молекул подчиняется законам классической механики (пример - идеальный газ).
Манометр – прибор для измерения давления.
Молекула – наименьшая частица вещества, обладающая его основными химическими свойствами и состоящая из атомов, соединенных между собой химическими связями.
Моль – единица СИ количества вещества. В 1 моле содержится столько структурных элементов вещества (атомов, молекул, ионов и др.), сколько атомов содержится в 0,012 кг 12С (нуклида углерода атомной массой 12).
Насыщенный пар - пар, находящийся в динамическом равновесии со своей жидкостью: число уходящих из поверхностного слоя жидкости молекул в процессе испарения и возвращающихся в нее молекул при конденсации за одно и то же время будет одинаковым.
Необратимые процессы – физические процессы, которые могут самопроизвольно протекать только в одном определенном направлении. Систему, в которой произошли необратимые процессы, нельзя вернуть в исходное состояние без того, чтобы в окружающей среде не осталось каких-либо изменений. В замкнутых системах необратимые процессы сопровождаются возрастанием энтропии. В открытых системах (которые могут обмениваться энергией или веществом с окружающей средой), при необратимых процессах энтропия может оставаться постоянной или даже убывать за счет обмена энтропией с внешней средой. Однако во всех случаях остается положительным производство энтропии, т.е. ее возрастание в системе за единицу времени из-за наличия необратимых процессов.
Обратимый процесс в термодинамике - процесс, для которого возможен обратный переход из конечного состояния в начальное через те же промежуточные состояния, что и в прямом процессе, но без изменения состояния окружающей среды.
Параметры состояния – физические величины, характеризующие состояние термодинамической системы: температура, давление, удельный объем, намагниченность, электрическая поляризация и т.д.
Парообразование – переход вещества из конденсированной фазы (жидкой или твердой) в газовую (фазовый переход I рода), для осуществления которого веществу необходимо подвести некоторое количество теплоты.
Парциальное давление – давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
Первое начало термодинамики – один из двух основных законов термодинамики, представляет собой закон сохранения энергии для систем, в которых существенное значение имеют тепловые процессы. Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счет своей внутренней энергии или какого-либо внешнего источника энергии.
Часто формулируют как невозможность существования вечного двигателя 1-го рода, который совершал бы работу, не черпая энергию из какого-либо источника энергии.
Перегретый пар - пар, имеющий температуру выше температуры насыщения при том же давлении.
Пересыщенный пар – пар, давление которого выше давления насыщенного пара при тех же условиях.
Поверхностная энергия – избыток энергии поверхностного слоя на границе раздела фаз (по сравнению с энергией вещества внутри тела), обусловленной различием межмолекулярных взаимодействий в обеих фазах.
Про¢милле (0/00 ) – единица относительной величины (безразмерного отношения двух физических величин, 1 0/00 = 10-3 = 0,1 %.
Равновесие термодинамическое – состояние системы, в которое она самопроизвольно приходит через достаточно большой промежуток времени в условиях изоляции от окружающей среды. В состоянии равновесия все параметры системы не меняются со временем. Состояние системы, выведенной из термодинамического равновесия, называется н еравновесным.
Смачивание – явление, возникающее при соприкосновении жидкости с поверхностью твердого тела или др. жидкости. Выражается, в частности, в растекании жидкости по твердой поверхности, находящейся в контакте с газом (паром) или другой жидкостью.
Сублимация (возгонка) – переход вещества из кристаллического состояния непосредственно (без плавления) в газообразное, одна из разновидностей парообразования; происходит с поглощением теплоты (фазовый переход I-ого рода).
Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Температура кипения – температура равновесного перехода жидкости в пар при постоянном внешнем давлении.
Теплообмен – самопроизвольный необратимый процесс переноса теплоты, обусловленный градиентом температуры.
Теплота – форма беспорядочного (теплового) движения образующих тело частиц (молекул, атомов, электронов, фотонов и т.д.). Количественной мерой теплоты служит количество теплоты, т.е. количество энергии, получаемой или отдаваемой системой при теплообмене. Наряду с работой количество теплоты является мерой изменения внутренней энергии системы.
Термодинамическая система – совокупность макроскопических тел, которые могут взаимодействовать между собой и с другими телами (внешней средой) - обмениваться с ними энергией и веществом.
Тепловая машина – периодически действующий двигатель, совершающий работу за счет получаемого извне тепла. Тепловая машина работает по прямому циклу. Машина, работающая по обратному циклу, называется холодильной машиной или нагревателем в зависимости от назначения.
Третье начало термодинамики (теорема Нернста) – закон термодинамики, согласно которому энтропия любой системы стремится к конечному пределу, не зависящему от давления, плотности или фазы, при стремлении температуры к абсолютному нулю.
Точка росы – температура, до которой должен охладиться воздух, чтобы находящийся в нем водяной пар достиг состояния насыщения (при данной влажности воздуха и неизменном давлении).
Уравнение состояния – уравнение, связывающее давление, объем и температуру физически однородной системы в состоянии термодинамического равновесия.
Фаза в термодинамике – термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний.
Фазовый переход – переход вещества из одной фазы в другую.
Бывают I–го и II–го рода. Фазовый переход, сопровождающийся скачкообразным изменением энергии или других величин, связанных с энергией, например, плотности, называется фазовым переходом I–го рода. Для фазовых переходов II-го рода характерно отсутствие скачков плотности вещества, концентрации компонентов, теплоты перехода.
Число степеней свободы механической системы – число независимых координат, определяющих ее положение и конфигурацию в пространстве.
Энтальпия (теплосодержание) – термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве основных независимых переменных энтропии и давления.
Энтропия – величина, являющаяся мерой необратимого рассеяния энергии.
Явления переноса – необратимые процессы, в результате которых в физической системе происходит пространственный перенос массы, импульса, энергии, электрического заряда, энтропии или какой-либо другой физической величины.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 343; Нарушение авторских прав?; Мы поможем в написании вашей работы!