
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции с молекулярным галогеном
|
|
|
|
Галогенирование алканови в боковую цепь аренов
Молекулярный галоген реагирует с алканами и алкиларенами по следующей схеме:
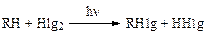
Механизм галогенирования является радикальным цепным процессом (SR), который инициируется как термически, так и облучением светом:



Реакция начинается с образования радикалов галогена. Отщепление водорода процесс эндотермический. В результате второй стадии (экзотермической) образуется алкилгалогенид и регенерируется радикал галогена. При хлорировании кинетические цепи значительно длиннее (до 104), чем при бромировании.
Тепловой эффект реакций фторирования, хлорирования, бромирования и иодирования алканов соответственно около 460, 105, 32, –50 кДж/моль. Поэтому прямое фторирование технически трудноосуществимо, хлорирование требует организации отвода тепла реакции, бромирование — подогрева реакционной массы, а иодирование алканов иодом не идет, даже при специальном инициировании реакции.
Реакционная способность исходных веществ и направление реакции гомолитического галогенирования определяется стабильностью радикалов, образующихся в процессе реакции (т. е. строением субстрата). Стабильность радикалов уменьшается в ряду бензильный, аллильный >> третичный > вторичный > первичный > метильный > винильный, фенильный:

Устойчивость радикалов зависит от делокализации свободного электрона, которая более всего выражена в бензильном (аллильном) радикале. Поэтому при галогенировании в первую очередь замещается бензильный (аллильный) атом водорода, затем — третичный, вторичный, первичный и, в последнюю очередь — винильный (фенильный).
Наибольшая селективность реакции проявляется при бромировании, наименьшая — при фторировании. С ростом температуры селективность процесса падает.
|
|
|
Недостатком радикально-цепного галогенирования являются низкая селективность процесса и полигалогенирование. Для получения моногалогеналканов процесс приходится вести в избытке углеводорода при малой степени превращения.
Галогенирование с использованием специфических
переносчиков галогена (СПГ)
Специфические переносчики галогена позволяют в значительной мере устранить недостатки гомолитического галогенирования молекулярным галогеном.
Для радикального хлорирования в качестве специфического переносчика галогена наиболее часто используют сульфурилхлорид (SO2Cl2), а для бромирования — N-бромсукцинимид (NБС). Инициатором радикальной реакции с участием СПГ может быть как УФ освещение или нагрев, так и химические реагенты, например, перекись бензоила и др.
Химизм хлорированиясульфурилхлоридом может быть представлен следующей схемой:
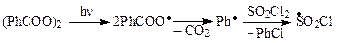
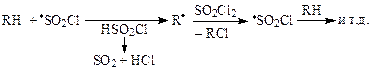
Отличие механизмов галогенирования молекулярным хлором и сульфурилхлоридом заключается в том, что в лимитирующей стадии (отщепление атома водорода) участвует не атом хлора, а значительно менее активный радикал–переносчик SO2Cl ·, реакционная способность которого легко регулируется температурой реакции, что позволяет замещать только наиболее подвижный атом водорода и получать моногалогениды.
Химизм бромированияN-бромсукцинимидом несколько отличается от хлорирования сульфурилхлоридом. Функция N-БС сводится к обеспечению низкой стационарной концентрации брома.
Под влиянием инициаторов образуется каталитическое количество атомарного брома, который реагирует с субстратом и выделяется HBr (некоторые авторы считают, что это количество HBr всегда есть в реагенте). В результате быстрой ионной реакции бромоводорода с N-БС выделяется молекулярный бром, затем образуется радикал Br · и начинается цепная реакция:
|
|
|

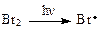

Имеется множество других переносчиков галогена. Во всех случаях необходим катализатор, инициирующий реакцию. Обычно это пероксид или УФ облучение.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 446; Нарушение авторских прав?; Мы поможем в написании вашей работы!