
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика химических процессов
|
|
|
|
Кинетика – это раздел химии, изучающий скорость протекания химических реакций, а также факторы влияющие на ее величину.
О принципиальной осуществимости процесса судят по величине изменения энергии Гиббса системы. Однако эта величина не может характеризовать скорость протекания реакции.
Например: реакция взаимодействия оксида азота(II) с кислородом
2NO(г) + О2(г) = 2NO2(г), ∆С°298 = - 150 кДж
характеризуется ∆С°298< 0 и протекает быстро при комнатной температуре. В то время как реакция: 2H2(г) + О2(г) = 2Н2О(г), ∆С°298 = -456,5 кДж характеризуется значительно большим уменьшением энергии Гиббса, в обычных условиях практически не протекает. Таким образом, для полного описания химической реакции необходимо знать также закономерности ее протекания во времени, т.е. ее скорость.
Скорость гомогенной химической реакции – изменение количества вещества, происходящее в единицу времени в единице объема:
υгомоген.реакции= Δn /Δt ∙V
Скорость гетерогенной химической реакции – количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади раздела фаз:
υгетероген.реакции= Δn/Δt ∙ S,
где S – площадь раздела фаз.
Истинная или мгновенная скорость определяется по тангенсу угла наклона касательной в данной точке кривой скорости υ = tg α (рис. 3)
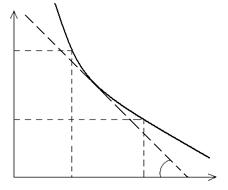
C, моль/л
С1
С2
α
t1 t2 t, время
Рис.3 График изменения концентрации исходного вещества в процессе реакции
Скорость химической реакции зависит от:
· природы веществ;
· концентрации реагирующих веществ;
· давления (для газовых систем);
· температуры системы;
· площади поверхности (для гетерогенных систем);
· наличия в системе катализатора
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 879; Нарушение авторских прав?; Мы поможем в написании вашей работы!