
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соли щелочных и щелочноземельных металлов. Химические основы применения соединений S-металлов в медицине и фармации
|
|
|
|
Амфотерность гидроксида бериллия.
Гидроксиды щелочных и щелочноземельных металлов.
Химические свойства
1. Взаимодействие с кислородом:
Из элементов I группы только литий образует оксид:
4Li + O2 → 2Li2O
Натрий при горении образует пероксид:
2Na + O2 → Na2O2
Пероксиды щелочных металлов можно считать солями пероксида водорода. В водном растворе они гидролизуются как соли слабой кислоты:
Na2O2 + H2O ↔ NaOH + NaHO2
Супероксиды (надпероксиды) характерны для калия, рубидия, цезия.
К + О2 → КО2
Они легко разлагаются, выделяя свободный кислород:
2КО2 + 2Н2О → 2КОН + Н2О2 + О2↑
Озониды известны для калия, рубидия, цезия.
К + О3 → КО3
При взаимодействии с водой они выделяют наибольшее количество кислорода:
2КО3 + Н2О → 2КОН + 2,5О2↑
2. При взаимодействии S-металлов с водородом образуются гидриды:
2Li + H2 → 2LiH (t)
Ca + H2 → CaH2 (t)
Для гидридов характерны восстановительные свойства:
NaH + H2O → NaOH + H2↑
NaH + HCl → NaCl + H2↑
BaH2 + 2H2O → Ba(OH)2 + 2H2↑
BaH2 + 2HCl → BaCl2 + 2H2↑
3. S-металлы активно реагируют с водой и кислотами:
2Na + H2O → 2NaOH + H2↑
2Na + 2HCl → 2NaCl + H2↑
2Na + H2SO4(p) → Na2SO4 + H2↑
Ca + 2H2O → Ca(OH)2 +H2↑
Mg + H2O (хол) ≠
Mg + 2H2O (гор) → Mg(OH)2↓ + H2↑
Ca + 2HCl → CaCl2 + H2↑
Ме(ОН) – общая формула гидроксидов S-металлов I группы. Называют их щелочами. Они хорошо растворимы в воде. Очень агрессивные, едкие вещества. Используются во многих реакциях органического и неорганического синтеза.
Ме(ОН)2 – общая формула гидроксидов S-металлов II группы.
Mg(OH)2 – нерастворимое основание
Ca(OH)2 – сильное основание (щелочь)
Be(OH)2 – амфотерный гидроксид. В воде он нерастворим, но легко растворяется как в кислотах, так и в щелочах:
Ве(OH)2 + 2NaOH → Na2[Be(OH)4]
Be(OH)2 + 2HCl → BeCl2 + 2H2O
NaCl, KCl, CaCl2 - хлориды
Na2SO4, K2SO4, CaSO4 - сульфаты
Na2CO3, K2CO3, CaCO3 - карбонаты
Na3PO4, K3PO4, Ca3(PO4)2 - фосфаты
NaCl – хлорид натрия, поваренная или каменная соль; пищевой продукт, консервирующее средство, сырье для получения соды, Na2CO3, хлора, NaOH. Изотонический раствор NaCl (0,9%) используется в медицине (физиологический раствор).
NaBr – бромид натрия; применяется как седативное средство в медицине.
NaHCO3 - гидрокарбонат натрия, питьевая или пищевая сода.
Водные растворы имеют слабощелочную среду в результате гидролиза:
NaHCO3 + H2O ↔ H2CO3 + NaOH
Поэтому используются как лекарственное средство для понижения кислотности желудочного сока.
Na2SO4∙10H2O – сульфат натрия (десятиводный), глауберова соль, используемая как слабительное.
Na2B4O7∙10H2O – декагидрат тетрабората натрия – бура, применяется как антисептическое средство для полосканий, спринцеваний и т.д.
KMnO4 – перманганат калия, используется в медицине как дезинфицирующее средство.
CaSO4∙2H2O – дигидрат сульфата кальция, используется в хирургии при переломах для изготовления гипсовых повязок.
Ионы щелочных и щелочноземельных металлов входят в состав комплексных соединений как комплексообразователи, в живых организмах эти металлы образуют комплексы с белками или другими биолигандами. Например, Mg2+ играет роль комплексообразователя в одном из важнейших соединений растительного мира – пигмента хлорофилла.
Для живых систем характерны комплексы, содержащие полидентантные органические лиганды типа комплексонов. Примером подобных веществ может служить синтетический препарат трилон Б – двуводный кристаллогидрат двунатриевой соли ЭДТА (этилендиаминтетрауксусной кислоты):
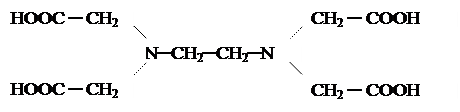

|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1553; Нарушение авторских прав?; Мы поможем в написании вашей работы!