
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения азота - III
|
|
|
|
При высоких температурах азот окисляет многие металлы и неметаллы, образуя нитриды:
3 Mg + N2 = Mg3N2
2 B + N2 = 2 BN
3 H2 + N2 = 2 NH3
Свойства нитридов более или менее закономерно изменяются по периодам и группам периодической системы. Например, в малых периодах наблюдается переход от основных нитридов к кислотным:
Na3N, Mg3N2 AlN Si3N4, P3N5, S4N4, Cl3N
основные амфотерные кислотные
Нитриды щелочных и щелочноземельных металлов образованы с помощью ионных связей. Азот в них проявляет степень окисления -3 и существует в виде ионов N3-. С элементами третьей группы азот образует нитриды BN, AlN при помощи ковалентных связей, а с металлами Ti, Hf, U и другими образует нитриды, имеющие структуру сплавов внедрения.
Все нитриды – твердые кристаллические вещества с высокой температурой плавления; многие из них представляют собой высокомолекулярные вещества. Они проводят электрический ток и устойчивы к нагреванию. Нитриды металлов получили значительное распространение в машиностроительной и химической промышленности. В машиностроении прибегают к получению нитридов металлов непосредственно на готовых изделиях из стали, легированной хромом, алюминием, ванадием, молибденом и другими металлами. Нитриды получаются при нагревании деталей до 490 - 5600С в атмосфере аммиака, который диссоциирует:
2 NH3 = N2 + 3 H2
Выделившийся атомарный азот образует нитриды алюминия, хрома, железа и других элементов. Образовавшаяся пленка твердого раствора азота в стали, содержащая нитриды металлов, повышает поверхностную твердость металлов, сопротивление истиранию и антикоррозионную устойчивость. Процесс получения нитридов непосредственно на поверхности металлов называется азотированием.
В химической промышленности нитрид железа применяется в качестве катализатора при ожижении твердого топлива.
Аммиак
Строение молекулы
Азот образует с водородом несколько соединений, из которых важнейшим является аммиак. Электронная формула молекулы аммиака такова:
H
...
:N· + 3H· ®:N:Н
· ××
Н
Видно, что из четырех электронных пар при азоте три общие (связывающие) и одна неподеленная (несвязывающая).
Молекула аммиака имеет форму пирамиды:
N
 H H
H
H H
H
|
Аммиак очень хорошо растворяется в воде (при 20°С в 1 л воды растворяется ~ 700л аммиака).
25%-ный водный раствор называют «нашатырным спиртом».
Химическая связь N-Н полярна: положительный заряд сосредоточен на атомах водорода, отрицательный – на атоме азота. Вследствие этого между молекулами аммиака образуется водородная связь, что можно изобразить так:
| Н H |d- d+ | H - N: … H – N: | | H H |
Поэтому аммиак существует в водном растворе в виде гидрата NH3•H2O.
Благодаря водородным связям аммиак имеет сравнительно высокие температуры плавления и кипения, а также высокую теплоту испарения, он легко сжижается.
Способы получения
1. Промышленный синтез
N2 + 3H2 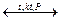 2NH3 + Q
2NH3 + Q
2. В лабораторных условиях аммиак получают действием щелочей на твердые соли аммония:
2NH4Cl + Ca(OH)2 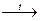 2NH3↑ + CaCl2 + 2H2O
2NH3↑ + CaCl2 + 2H2O
Химические свойства
I. Аммиак – сильный восстановитель
В жидком аммиаке растворяются щелочные и щелочноземельные металлы, неметаллы (фосфор, сера, йод) и многие неорганические и органические соединения.
1. аммиак сгорает в кислороде и в воздухе (предварительно подогретом) с образованием азота и воды (без катализатора):
4 NH3 + 3 О2 = 2 N2 + 6 Н2О
2. с кислородом (в присутствии катализаторов)
4NH3 + 5O2  4NO + 6H2O
4NO + 6H2O
3. с галогенами
8NH3 + 3Cl2 = N2 + 6NH4Cl
4. при нагревании он восстанавливает оксид меди (II), а сам окисляется до свободного азота:
+2 -3 0 0
3 CuO + 2 NH3 = 3 Cu + N2 + 3 H2O
5. растворенный в воде аммиак реагирует с различными окислителями, например:
10NH3 + 6KMnO4 + 9H2SO4 = 5N2↑ + 6MnSO4 + 3K2SO4 + 24H2O
При окислении аммиака гипохлоритом натрия получают другое водородное соединение азота – гидразин N2H4
2NH3 + 6NaOCl = 5N2H4 + NaCl + H2O
II. Водный раствор аммиака – слабое основание
Образующийся при взаимодействии с водой гидрат аммиака частично диссоциирует:
..
H3N: + H-O: ®[NH4]+ + [OH]-
|
H
Комплексный катион NH4+ - продукт присоединения ионов Н+ к молекуле NH3 по донорно-акцепторному механизму. За счет освобождающихся из молекул воды ионов ОН- раствор аммиака приобретает слабощелочную реакцию и проявляет свойства оснований.
1. Важным химическим свойством аммиака является его взаимодействие с кислотами с образованием солей аммония. В этом случае к молекуле аммиака присоединяется ион водорода кислоты, образуя ион аммония, входящий в состав соли:
NH3 + HCl = NH4Cl;
NH3 + H3РО4 = NH4Н2РО4
2. При пропускании аммиака в водные растворы солей металлов, гидроксиды которых очень плохо растворяются в воде, происходит осаждение Me(OH)x:
3NH3 + 3H2O + AlCl3 = Al(OH)3↓ + 3NH4Cl
III. NH3 – лиганд в комплексных соединениях
Молекулы NH3 способны образовывать донорно-акцепторные связи не только с ионами Н+, но и с катионами целого ряда переходных металлов (Ag+, Cu2+, Cr3+, Co2+ и др.). Это приводит к возникновению комплексных ионов – [Ag(NH3)2]+, [Cu(NH3)4]2+, [Cr(NH3)6]3+ и др., которые входят в состав комплексных соединений – аммиакатов.
Благодаря образованию растворимых аммиакатов в водном растворе аммиака растворяются нерастворимые в воде оксиды, гидроксиды, соли металлов-комплексообразователей.
В частности, в аммиаке легко растворяются Ag2O, Cu2O, Cu(OH)2, AgCl:
Ag2O + 4NH3 + H2O = 2[Ag(NH3)2]OH
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
AgCl + 2NH3 = [Ag(NH3)2]Cl
Аммиачные растворы Ag2O, Cu2O, Cu(OH)2 используются как реактивы в качественном анализе (обнаружение альдегидов, многоатомных спиртов).
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1799; Нарушение авторских прав?; Мы поможем в написании вашей работы!