
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Азотная кислота
|
|
|
|
Химические свойства
Способы получения
Азотистая кислота и нитриты
Молекулярная формула – HNO2
Графическая формула: H-O-N=O
При действии на раствор какого-нибудь нитрита разбавленной серной кислотой получается свободная азотистая кислота:
2 NaNO2 + H2SO4 = Na2SO4 + 2 HNO2
Она принадлежит к числу слабых кислот и известна только в сильно разбавленных водных растворах. При концентрировании раствора или при его нагревании азотистая кислота распадается:
2 HNO2 = NO + NO2 + H2O
Степень окисления азота в азотистой кислоте равна +3, т.е. является промежуточной между низшими и высшей из возможных значений степени окисленности азота. Поэтому HNO2 проявляет окислительно-восстановительную двойственность. Под действием восстановителей она восстанавливается (обычно до NO), а в реакциях с окислителями – окисляется до HNO3. Примерами могут служить следующие реакции:
2 HNO2 + 2 KI + H2SO4 = 2 NO↑ + I2 + K2SO4 + 2 H2O
5 HNO2 + 2 KMnO4 + 3 H2SO4 = 5 HNO3 + 2 MnSO4 + K2SO4 + 3 H2O.
Соли азотистой кислоты – нитриты – образуют кристаллы, хорошо растворимые в воде (за исключением нитрита серебра). Нитрит натрия NaNO2 применяется при производстве различных красителей. В отличие от самой азотистой кислоты, ее соли устойчивы. Нитриты токсичны.
1. Пропускание эквимолярной смеси оксидов азота II и IV в раствор щелочи:
NO + NO2 + 2NaOH = 2NaNO2 + H2O
2. Обменные реакции между NaNO2 и солями металлов:
NaNO2 + AgNO3 = AgNO2↓ +NaNO3
3. Если нагревать нитрат калия или натрия, то они теряют часть кислорода и переходят в соли азотистой кислоты HNO2. Разложение идет легче в присутствии свинца, связывающего выделяющийся кислород:
KNO3 + Pb = KNO2 + PbO
Как и азотистая кислота, нитриты обладают окислительно-восстановительной двойственностью:
KNO2 + H2O2 = KNO3 + H2O
3KNO2 + 2KMnO4 + H2O = 3KNO3 + 2MnO2↓ + 2KOH
2KNO2 + 2KI + 2H2SO4 = 2NO + I2 + 2K2SO4 + 2H2O
NH4NO2 = N2↑ + 2H2O
Молекулярная формула – HNO3
Валентная схема молекулы азотной кислоты:
....
H: O: N:: O
˙˙ ˙˙ ˙˙
:O:
˙˙
или H-O-N=O
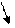
O
Атом азота образует три связи с атомами кислорода по обменному механизму и одну связь – по донорно-акцепторному механизму.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1275; Нарушение авторских прав?; Мы поможем в написании вашей работы!