
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Один моль вещества содержит количество молекул или атомов, равное постоянной Авогадро
|
|
|
|
Закон кратных отношений, открытый Дальтоном, утверждал, что, если два элемента образуют между собой несколько молекулярных соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа. Например, при взаимодействии азота с кислородом образуются пять оксидов. На 1 грамм азота в образующихся молекулах приходится 0,57, 1,14, 1,71, 2,28, 2,85 грамм кислорода, что соответствует отношением 2:1, 1:1, 2:3, 1:2, 2:5 в этих оксидах, и поэтому состав молекул этих оксидов можно записать в виде N2O, NO, N2O3, NO2, N2O5.
Возьмём другой пример. Для образования молекулы углекислого газа требуется соединить один атом углерода с двумя атомами кислорода (CO2) или по весу, например, 12 г углерода и 32 г кислорода. Из 12 г углерода можно создать также газ метан (CH4), если они вступят в реакцию с 4 г водорода. Из этого следует, что в 1 г водорода, 12 г углерода и 16 г кислорода содержится одно и то же число атомов. Оказалось, что самыми лёгкими являются атомы водорода, поэтому массу остальных атомов сначала измеряли в единицах равных массе атома водорода. Однако сейчас за единицу массы взята 1/12 массы атома углерода, его изотопа 12С. Таким образом, относительной молекулярной или атомной массой вещества называют отношение массы его молекулы и атома к 1/12 массе атома углерода.
Чем больше молекул в кусочке или объёме данного вещества, тем больше вещества там содержится. Чтобы оценить, сколько находится вещества в данном его образце, число молекул в нём сравнивают с числом NА молекул в 12 г углерода. Таким образом, количество вещества, n, содержащееся в некотором его кусочке или объёме, равно:

где N- число молекул в данном его образце. Единицей измерения количества вещества в системе СИ служит моль – количество вещества, содержащееся в 12 г углерода. Другими словами, один моль вещества содержится в его массе, выраженной в граммах и равной относительной молекулярной (или атомной) массе этого вещества. Так, моль углерода содержится в 12 его граммах, моль кислорода (O2) – в 32 его граммах, и т.д.
Число атомов (или молекул) в одном моле называют числом или постоянной Авогадро, NА, измерить которую удалось только в начале XX века французскому физику Жану Перрену, и за эту работу, демонстрирующую «дискретную природу материи» в 1926 г. он был удостоен Нобелевской премии по физике. Согласно современным измерениям:

Молярной массой, M называют отношение массы m данного образца вещества к количеству n вещества, содержащегося в нём:

которая численно равна массе вещества, взятого в количестве одного моля. Молярная масса в системе СИ выражается в кг/моль. Найдём молярную массу воды (H2O). 1 моль воды содержится в её 0,018 кг, и значит, MH2O= 0,018 кг/моль.
Абсолютное значение массы mВ атомов или молекул любого вещества можно легко вычислить, если знать молярную массу M этого вещества и постоянную Авогадро, NА. Так как NА равна числу атомов или молекул в одном моле вещества, то очевидно следующее равенство:
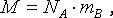
дающее возможность определить mВ по известному значению молярной массы. Например, масса одной молекулы воды равна 3.10-26 кг. Аналогично можно вычислить массу атома углерода, 1/12 которой приняли за атомную единицу массы (а.е.м):
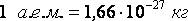
Знание числа Авогадро даёт также возможность оценить размер молекул или объём V0, приходящийся на одну молекулу. Пусть данное вещество имеет молярную массу M, а его образец, содержащий n молей этого вещества, имеет массу m, объём V и плотность, т.е. отношение массы к объёму, r. Найдём V0, разделив V на число молекул N в образце и используя (19.1) и (19.2):
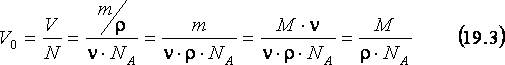
Например, объём, приходящийся на одну молекулу воды (r = 103 кг/м3, М=0,018 кг/моль), согласно (19.3), составит 3.10-29 м3. Если считать, что молекула имеет форму кубика этого объёма, то длина ребра этого кубика, или размер молекулы воды равен 3,1.10-10 м.
Вопросы для повторения:
· Что такое относительная молекулярная (или атомная) масса?
· Что такое и в чём измеряется количество вещества?
· Чему равна постоянная Авогадро?
· Сформулируйте определение молярной массы· Как с помощью числа Авогадро вычислить массу атома и его приблизительные размеры?
§ 20. ТЕПЛОВОЕ ДВИЖЕНИЕ МОЛЕКУЛ: ДИФФУЗИЯ И БРОУНОВСКОЕ ДВИЖЕНИЕ
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1070; Нарушение авторских прав?; Мы поможем в написании вашей работы!