
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи и упражнения для самостоятельного решения. Примеры решения задач
|
|
|
|
Примеры решения задач
Пример 1.1. Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
Na → NaOH → NaHS → Na2S → Na2SO4 → NaCl.
Решение. NaOH (гидроксид натрия) – основание (щелочь). Щелочи можно получить взаимодействием активного металла (в данном примере натрия) с водой:
2Na + 2H2O = 2NaOH + H2↑.
NaHS (гидросульфид натрия) – кислая соль. Кислые соли получаются при взаимодействии многоосновных кислот с основаниями в тех случаях, когда количество взятого основания недостаточно для образования средней соли:
H2S + NaOH = NaHS.
Na2S (сульфид натрия) – средняя соль. Образуется при действии избытка щелочи на кислую соль:
NaHS + NaОН = Na2S + H2O.
Na2SO4 (сульфат натрия), NaCl (хлорид натрия) – средние соли. Средние соли можно получить взаимодействием кислоты и соли:
H2SO4 + Na2S = Na2SO4 + H2S↑,
взаимодействием двух солей:
Na2SO4 + СаCl2 = 2NaCl + СaSO4↓.
Пример 1.2. С какими из указанных ниже веществ будет взаимодействовать H2SO4: CO2; NaOH; BaCl2; HCl; Fe2O3. Написать уравнения соответствующих реакций.
Решение. Определяем, к каким классам относятся указанные соединения: CO2 – кислотный оксид, NaOH – основание (щелочь), BaCl2 – соль, HCl − кислота, Fe2O3 – основной оксид. Серная кислота будет взаимодействовать с основанием, основным оксидом и солью:
H2SO4 + 2NaOH = Na2SO4 + 2H2O;
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O;
H2SO4 + BaCl2 = BaSO4↓ + 2HCl.
1.1. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
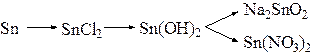 .
.
б). Какие из приведенных веществ будут взаимодействовать между собой: Ca(OH)2 и NaOH; Pb(OH)2 и KOH; H2SO4 и H2SO3; HCl и Na2S; HNO3 и MgO? Написать уравнения соответствующих реакций.
1.2. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2O3 → Fe2(SO4)3.
б). Какие из приведенных оксидов будут реагировать с HCl: N2O5; SO3; Al2O3; Cl2O7; ZnO; K2O? Написать уравнения соответствующих реакций.
1.3. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
P → P2O5 → H3PO4 → Na3PO4 → Ca3(PO4)2.
б). Закончить уравнения реакций, доказывающих амфотерность оксида
свинца (II): основные свойства PbO + HNO3 → …;
кислотные свойства PbO + KOH  ….
….
1.4. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
N2 → NH3 → (NH4)2SO4 → NH4Cl → NH3 → NH4NO3.
б). Какие из приведенных оксидов реагируют с NaOH: MgO; Cl2O; Na2O; CrO3; CaO; CO2? Составить уравнения соответствующих реакций.
1.5. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
Si → SiO2 → K2SiO3 → H2SiO3 → SiO2.
б). Какие из указанных ниже веществ могут взаимодействовать с раствором KOH: HI; CuCl2; SO2; Ba(OH)2; SnO? Написать уравнения соответствующих реакций.
1.6. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
CaSO3 ← SO2 ← S → FeS → H2S → KHS.
б). Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: Na2S; Fe2(SO4)3; K 3PO4.
1.7. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Ca → Ca(OH)2 → CaCO3 → CaCl2 → Ca3(PO4)2.
б). Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaNO3; CaHРO4; CuOHCl.
1.8. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Cu → CuO → Cu(NO3)2 → Cu(OH)2 → CuCl2.
б). Между какими из приведенных пар веществ возможна реакция: CO2 и SO2; LiOH и CO2; P2O5 и CaO; NaOH и KOH; Li2O и ZnO; Li2O и Na2O? Составить уравнения соответствующих реакций.
1.9. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Cd → CdO → Cd(NO3)2 → Cd(OH)2 → CdSO4.
б). С какими из указанных ниже веществ может взаимодействовать серная кислота: HCl; BaCl2; MgO; CO2; NaOH; ZnO? Составить уравнения соответствующих реакций.
1.10. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
Zn → ZnCl2 → Zn(OH)2 → ZnO → K2ZnO2.
б). Написать уравнения реакций образования солей: Na2SO3; Fe2(SO4)3; Ba(NO3)2 в результате взаимодействия основания и кислотного оксида.
1.11. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
S → SO2 → SO3 → H2SO4 → KHSO4 → K2SO4.
б). Составить уравнения реакций образования солей: CaCO3; Al2(SO4)3; Na3PO4 в результате взаимодействия основного и кислотного оксидов.
1.12. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Al → Al2(SO4)3 → Al(OH)3 → Al2O3 → KAlO2.
б). Закончить уравнения реакций, доказывающих амфотерность оксида олова (II): основные свойства SnO + HCl → …;
кислотные свойства SnO + KOH  ….
….
1.13. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
Ba → BaO → Ba(OH)2 → Ba(NO3)2 → BaCO3 → BaCl2.
б). Какие из приведенных оксидов взаимодействуют с КОН: Na2O; CO2; Ga2O3; MgO; CuO; Mn2O7? Написать уравнения соответствующих реакций.
1.14. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
Fe(NO3)3 → Fe(OH)3 → Fe2O3 → FeO → FeCl2 → FeS.
б). Какие вещества могут быть получены при взаимодействии кислоты с солью? Кислоты с основанием? Соли с солью? Привести примеры соответствующих реакций.
1.15. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Mg → MgSO4 → Mg(OH)2 → MgOHNO3 → Mg(NO3)2.
б). Составить уравнения реакций, при помощи которых, исходя из четырех простых веществ – калия, серы, водорода и кислорода, можно получить гидроксид калия КОН; сульфид калия K2S; сероводородH2S.
1.16. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
ZnSO4 ← ZnO ← ZnS → ZnCl2 → Zn(OH)2 → Na2ZnO2.
б). Написать уравнения не менее четырех реакций, при помощи которых можно получить карбонат кальция CaCO3.
1.17. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
CuOHCl ← Cu(OH)2 ← CuSO4 ← Cu → CuO → CuCl2.
б). Написать уравнения реакций образования K2CrO4, Mg(NO3)2, BaSO4, Ca(ClO)2 в результате взаимодействия основания и кислотного оксида.
1.18. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → Fe2O3 → FeCl3.
б). Могут ли находиться совместно в растворе: Ba(OH)2 и FeCl3; HCl и H2S; NaOH и НBr; NaOH и KOH; HCl и Na2CO3? Дать обоснованный ответ и привести уравнения соответствующих реакций.
1.19. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Al → Al2O3 → AlCl3 → Al(OH)3 → NaAlO2.
б). Как, используя BaO, FeCl3, H2SO4, H2O, CuO, можно получить: гидроксид бария; гидроксид железа (III); сульфат меди (II)? Составить уравнения соответствующих реакций.
1.20. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Pb → PbS → PbO → Pb(NO3)2 → Pb(OH)2 → K2PbO2.
б). Составить уравнения четырех реакций, в результате которых образуется бромид натрия NaBr.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 603; Нарушение авторских прав?; Мы поможем в написании вашей работы!