
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическое введение. Определение молярной массы эквивалентов цинка
|
|
|
|
Определение молярной массы эквивалентов цинка
Лабораторная работа 2
Цель работы: изучить понятия «эквивалент», «молярная масса эквивалентов» и закон эквивалентов.
Задание: провести реакцию взаимодействия цинка с соляной кислотой и определить объем выделившегося водорода. На основании полученных данных вычислить массу водорода и молярную массу эквивалентов цинка. Выполнить требования к результату работы, оформить отчет, решить задачу.
Эквивалент (Э) – это реальная или условная частица вещества, соответствующая одному иону водорода в кислотно-основных или ионообменных реакциях, или одному электрону в окислительно-восстановительных реакциях. Под реальной частицей понимают реально существующие соединения (NaOH, H2SO4, H2O), под условной – доли этих реальных частиц (½ H2SO4, ½ H2O). Эквивалент – безразмерная величина, состав которой выражают с помощью знаков и формул. Например,
Э (NaOH) = NaOH; Э (H2SO4) = ½ H2SO4; Э (MgCl2 ) = ½ MgCl2; Э (Са) = ½ Са.
Единицей количества вещества эквивалентов является моль. Моль эквивалентов – это количество вещества, содержащего 6,02×1023 эквивалентов. Масса одного моля эквивалентов называется молярной массойэквивалентов (M эк)и выражаетсяв г/моль.
При определении молярной массы эквивалентов необходимо исходить из конкретной реакции, в которой участвует данное вещество.
Молярная масса эквивалентов вещества В, участвующего в окислительно-восстановительной реакции, рассчитывается по формуле
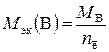 ,
,
где М В – молярная масса вещества В; n ē – число электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя.
Например, в реакции Mg0 + 2H+Cl = Mg+2Cl2 + H20 степень окисления магния изменяется от 0 до +2. Следовательно, магний теряет 2 электрона, т.е. одному электрону эквивалентна условная частица ½ атома Mg:
Э (Mg) = ½ Mg; М эк (Mg) = = 12 г/моль.
= 12 г/моль.
У водорода степень окисления меняется от +1 до 0, а т.к. молекула водорода состоит из двух атомов, то число принятых электронов будет равно 2. Таким образом, одному электрону эквивалентна условная частица ½ молекулы Н2:
Э (Н2) = ½ Н2 ; М эк (Н2) = 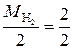 = 1 г/моль.
= 1 г/моль.
Закон эквивалентов: массы реагирующих друг с другом веществ пропорциональны их молярным массам эквивалентов:
 .
.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 522; Нарушение авторских прав?; Мы поможем в написании вашей работы!