
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Опыт 4. Реакции обмена, сопровождаемые гидролизом
|
|
|
|
Опыт 4. Реакции обмена, сопровождаемые гидролизом
Опыт 3. Смещение равновесия гидролиза при изменении температуры
Опыт 2. Смещение равновесия гидролиза при разбавлении раствора
Выполнение работы
Опыт 1. Реакция среды в растворах различных солей
На полоски универсальной индикаторной бумаги нанести по капле раствора хлорида натрия NaCl, сульфата меди CuSO4, нитрата свинца Pb(NO3)2, карбоната натрия Na2CO3, ацетата калия CH3COOK и ацетата аммония CH3COONH4. По изменению окраски индикаторной бумаги сделать вывод о реакции среды в растворе каждой соли.
Требования к результатам опыта
1. Составить сокращенные, полные ионные и молекулярные уравнения реакций гидролиза солей, указать рН среды. В случае ступенчатого гидролиза написать уравнения реакций только для первой ступени.
2. Сделать вывод, какие типы солей подвергаются гидролизу.
Налить в пробирку 1–2 мл раствора нитрата висмута Bi(NO3)3 и постепенно разбавлять водой до выпадения осадка. Прибавить в пробирку с осадком несколько капель концентрированной азотной кислоты. Наблюдать растворение осадка.
Требования к результатам опыта
1. Составить сокращенные, полные ионные и молекулярные уравнения реакции гидролиза нитрата висмута по первой и второй ступени.
2. Сделать вывод о смещении равновесия при разбавлении раствора и добавлении кислоты.
В пробирку налить 5–6 мл раствора ацетата натрия CH3COONa и добавить 1–2 капли фенолфталеина. Содержимое пробирки разделить на 2 части, одну из них оставьте для сравнения, другую – нагреть до кипения. Сравнить окраску индикатора в обеих пробирках. Дать пробирке охладиться и снова сравнить окраску индикатора в обеих пробирках.
Требования к результатам опыта
1. Составить сокращенное, полное ионное и молекулярное уравнение реакции гидролиза CH3COONa.
2. Сделать вывод о смещении равновесия при изменении температуры.
В одну пробирку налить 2–3 мл раствора сульфата меди (II), в другую – столько же хлорида железа (III). Затем в каждую пробирку добавить по 2–3 мл раствора карбоната натрия. Отметить выделение углекислого газа в обеих пробирках и выпадение осадков. В первой пробирке в осадок выпадает карбонат гидроксомеди (II), во второй – гидроксид железа (III).
Требования к результатам опыта
1. Закончить уравнения реакций в молекулярном и ионном виде:
CuSO4 + Na2CO3 + H2O = …;
FeCl3 + Na2CO3 + H2O = ….
2. Объяснить, почему не получились карбонаты меди и железа.
Пример 9.1. Какие продукты получатся при смешивании растворов AlCl3 и Na2S? Составить ионно-молекулярные и молекулярное уравнение реакции.
Решение. Соль AlCl3 гидролизуется по катиону, а Na2S – по аниону:
Al3+ + H2O ↔ AlOH2+ + H+,
S2− + H2O ↔ HS‾ + OH‾.
Гидролиз приведенных солей обычно ограничиваются первой ступенью. При смешивании растворов этих солей ионы H+ и OH‾ связываются в молекулы слабого электролита H2O, сдвигая гидролитическое равновесие вправо. Это приводит к тому, что усиливается гидролиз каждой из солей до образования Al(OH)3 и H2S. Ионно-молекулярные и молекулярное уравнения имеют следующий вид:
Al3+ + 3S2− + 6H2O = 2Al(OH)3↓ + 3H2S↑
2Al3+ + 6Cl− + 6Na+ +3S2− + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6Na+ + 6Cl−
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl.
Таким образом, продуктами гидролиза являются Al(OH)3 и H2S.
Пример 9.2. К раствору Na2CO3 добавили следующие вещества: а) HCl;
б) NaOH; в) Cu(NO3)2; г) K2S. В каких случаях гидролиз карбоната натрия усилится? Почему? Составить ионно-молекулярные уравнения гидролиза соответствующих солей.
Решение. Карбонат натрия Na2CO3 – соль слабой кислоты и сильного основания гидролизуется по аниону: СО32− + Н2О 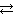 НСО3− + ОН− (1)
НСО3− + ОН− (1)
Чтобы усилить гидролиз соли, нужно удалить ионы ОН− и таким образом сместить равновесие (1) вправо. Этого можно достигнуть добавлением в раствор Na2CO3 веществ, растворы которых содержат ионы Н+. Ионы Н+ свяжут ионы ОН− из (1) в молекулы слабого электролита Н2О, в результате чего равновесие (1) смесится вправо и гидролиз усилится. В нашей задаче такими веществами являются кислота HCl (HCl → Н+ + Cl−) и соль Cu(NO3)2, содержащая ионы Н+ вследствие ее гидролиза по катиону Cu2+ + H2O 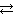 CuOH+ + H+.
CuOH+ + H+.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1184; Нарушение авторских прав?; Мы поможем в написании вашей работы!