
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Опыт 1. Получение золя гидроксида железа (III) методом конденсации
|
|
|
|
Выполнение работы
Опыт 1. Получение золя гидроксида железа (III) методом конденсации
Пробирку заполнить водой (примерно до половины ее объема) и поставить в горячую водяную баню. Через 5–7 минут внести в пробирку 2–3 капли концентрированного раствора FeCl3. Наблюдать образование краснооранжевого золя Fe(OH)3. Раствор сохранить для опыта 3.
Требование к результатам опыта
Указать состав ядра коллоидной частицы полученного золя, состав коллоидной частицы, состав мицеллы.
Опыт 2. Получение золя гидроксида железа (III) методом диспергирования осадка Fe(OH)3
В стакан объемом 50 мл налить 25 мл воды и добавить 10 капель 20 %-го раствора хлорида железа FeCl3. Перемешать содержимое стакана и после этого добавить по каплям раствор гидроксида аммония NH4OH до полного осаждения гидроксида Fe(OH)3.
После того как осадок уплотнится на дне стакана, осторожно слить с него избыток раствора. Осадок промыть 2–3 раза, добавляя к нему небольшие порции воды и сливая эту воду после того, как между ними и осадком четко обозначится граница раздела.
К осадку гидроксида железа (III) прилить 25 мл H2O и 3 капли 20 %-го раствора FeCl3. Смесь хорошо перемешать. Для ускорения процесса пептизации нагреть раствор на водяной бане. Прекратить нагревание, когда раствор приобретет устойчивую краснооранжевую окраску.
Требование к результатам опыта
Составить схему строения мицеллы золя гидроксида железа (III) в растворе хлорида железа FeCl3.
Опыт 3. Коагуляция золя гидроксида железа электролитами
Разлить в три пробирки золь гидроксида железа, полученный в опыте 1. По каплям прибавить в первую пробирку NaCl, во вторую – Na2SO4 , в третью – Na2HPO4. Считать число капель до изменения вида раствора (появления мути и осадка).
Требования к результатам опыта
1. Написать формулу мицеллы золя гидроксида железа.
2. Объяснить влияние заряда коагулирующего иона на время, проходящее до начала коагуляции.
Пример 10.1. Золь иодида серебра получен при добавлении к раствору AgNO3 избытка KI. Определить заряд частиц полученного золя и написать формулу его мицеллы.
Решение. При смешивании растворов AgNO3 и KI протекает реакция
AgNO3 + KI (изб.) = AgI + KNO3.
Ядро коллоидной частицы золя иодида серебра состоит из агрегата молекул (mAgI) и зарядообразующих ионов I‾, которые находятся в растворе в избытке и обеспечивают коллоидным частицам отрицательный заряд. Противоионами являются гидратированные ионы калия. Формула мицеллы иодида серебра имеет вид {[(m AgI)· n I‾·(n-x)К+· y H2O] x − + x К+∙ z H2O}0.
Пример 10.2. Золь кремневой кислоты был получен при взаимодействии растворов K2SiO3 и HCl. Написать формулу мицеллы золя и определить, какой из электролитов был взят в избытке, если противоионы в электрическом поле движутся к катоду.
Решение. Образование золя кремневой кислоты происходит по реакции
K2SiO3 + 2HCl = H2SiO3 + 2KCl.
Чтобы двигаться к катоду (отрицательному электроду) противоионы должны иметь положительный заряд, а коллоидные частицы золя должны быть заряжены отрицательно. На электронейтральном агрегате частиц (mH2SiO3) адсорбируются ионы элемента, входящего в состав ядра. Таковыми являются ионы HSiO3‾, которые образуются в результате гидролиза соли K2SiO3:
K2SiO3 + H2O 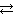 KHSiO3 + KOH или в ионной форме
KHSiO3 + KOH или в ионной форме
SiO32− + H2O 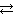 HSiO3‾ + OH‾.
HSiO3‾ + OH‾.
Ионы HSiO3‾, адсорбируясь на поверхности частиц золя кремниевой кислоты, сообщают им отрицательный заряд. Противоионами являются гидратированные ионы водорода H+. Формула мицеллы золя кремневой кислоты
{[(m H2SiO3) · n HSiO3‾·(n-x)H+∙ y H2O] x − + x H+∙ z H2O}.
Так как коллоидные частицы золя кремневой кислоты заряжены отрицательно за счет ионов HSiO3‾, то, следовательно, в избытке был взят K2SiO3.
Пример 10.3. Какого из веществ, K2SO4 или KCl, потребуется меньше, чтобы вызвать коагуляцию коллоидного раствора гидроксида железа (II), полученного по реакции FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl?
Решение. Из формулы коллоидной частицы золя гидроксида железа (II) [(m Fe(OH)2· n Fe2+ 2(n-x)Cl‾∙yH2O]2 x + видно, что частицы золя имеют положительный заряд. Коагуляцию золя вызывает тот из ионов прибавленного электролита, заряд которого противоположен заряду коллоидной частицы. В данной задаче – это ионы SO42− и Cl‾. Коагулирующая способность иона определяется его зарядом – чем больше заряд иона, тем больше его коагулирующая способность. Заряд иона SO42− больше заряда иона Cl‾, поэтому, чтобы вызвать коагуляцию коллоидного раствора гидроксида железа (II), раствора K2SO4 потребуется меньше, чем раствора KCl.
Пример 10.4. Составить схему строения мицеллы золя гидроксида меди (II) в растворе хлорида меди.
Решение. В состав мицеллы гидроксида меди входят: агрегат молекул (mCu(OH)2), адсорбированный слой, состоящий из зарядообразующих ионов меди Cu2+ и гидратированных противоионов хлора, и диффузный слой гидратированных противоионов хлора. Схема строения мицеллы гидроксида меди
{[(m Cu(OH)2·nCu2+ 2(n-x)Cl‾∙ y H2O]2 x + + 2 x Cl‾∙ z H2O}.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2748; Нарушение авторских прав?; Мы поможем в написании вашей работы!