
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическое введение. Химические свойства металлов
|
|
|
|
Химические свойства металлов
Лабораторная работа 14
Цель работы: изучить химические свойства металлов научиться составлять уравнения реакций взаимодействия металлов с водой, кислотами, щелочами.
Задание: провести реакции взаимодействия металлов с водой, щелочами, разбавленными и концентрированными растворами серной и азотной кислот. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Металлы, имея низкие потенциалы ионизации, легко отдают валентные электроны и образуют положительно заряженные ионы:
M − nē = Mn+.
Поэтому металлы в химических реакциях являются восстановителями и способны взаимодействовать с различными веществами − окислителями.
Рассмотрим некоторые типичные случаи такого взаимодействия.
1. Металлы высокой химической активности могут разлагать воду с вытеснением водорода при комнатных температурах:
2K + 2H2O = 2KOH + H2.
2. С кислотами металлы реагируют различно в зависимости от активности самого металла и окислительных свойств кислоты:
– В разбавленной серной кислоте и в растворах галогеноводородов окислителем является ион H +, поэтому в них растворяются металлы, стоящие в ряду напряжений до водорода:
Cd + H2SO4 (разб.) = CdSO4 + H2;
Ni + 2HCl = NiCl2 + H2.
– Концентрированная серная кислота является окислителем за счет S+6 и может при нагревании окислять металлы, стоящие в ряду напряжений после водорода. Продукты ее восстановления могут быть различными в зависимости от активности металла. При взаимодействии с малоактивными металлами кислота восстанавливается до SO2:
Hg + 2H2SO4 (конц.) = HgSO4 + SO2 + 2H2O.
При взаимодействии с более активными металлами продуктами восстановления могут быть как SO2, так и свободная сера и сероводород:
Cd + 2H2SO4 (конц.) = CdSO4 + SO2 + 2H2O;
3Zn+ 4H2SO4 (конц.) = 3ZnSO4 + S + 4H2O;
4Mg + 5H2SO4 (конц.) = 4MgSO4 + H2S + 4H2O.
В этих реакциях часть молекул серной кислоты играют роль среды.
– Азотная кислота является сильнейшим окислителем за счет N+5. Продукты восстановления различны и зависят от концентрации кислоты и активности металла:
HNO3 → NO2 → NO → N2O → N2 → NH4NO3.
При реакциях с концентрированной кислотой чаще всего выделяется NO2. При взаимодействии разбавленной азотной кислоты с малоактивными металлами выделяется NO. В случае более активных металлов выделяется N2O. Сильно разбавленная азотная кислота взаимодействует с активными металлами с образованием иона аммония, дающего с кислотой нитрат аммония.
Ag + 2HNO3 (конц.) = AgNO3 + NO2 + H2O;
3Ag + 4HNO3 (разб.) = 3AgNO3 + NO + H2O;
4Mg + 10HNO3 (разб.) = 4Mg(NO3)2 + N2O + 5H2O;
4Ca + 10HNO3 (оч. разб.) = 4Ca(NO3)2 + NH4NO3 + 3H2O.
Al, Fe, Cr концетрированной азотной кислотой пассивируются.
3. Со щелочами реагируют металлы, дающие амфотерные гидроксиды (бериллий, цинк, алюминий, олово, свинец), а также металлы, обладающие высокими степенями окисления в присутствии сильных окислителей:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2;
2Mo + 4KOH + 3O2 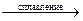 2K2MoO4 + 2H2O.
2K2MoO4 + 2H2O.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 469; Нарушение авторских прав?; Мы поможем в написании вашей работы!