
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Пример 17.1. Вычислить жесткость воды, зная, что в 500 л ее содержится 202,5 г Ca(HCO3)2
|
|
|
|
Пример 17. 1. Вычислить жесткость воды, зная, что в 500 л ее содержится 202,5 г Ca(HCO3)2.
Решение. Для решения задачи воспользуемся формулой
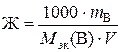 .
.
М эк (Ca(HCO3)2) = 162/2 = 81 г/моль.
Ж = 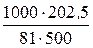 = 5 ммоль/л.
= 5 ммоль/л.
Пример 17. 2. Вычислить карбонатную жесткость воды, зная, что на титрование 100 мл этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 мл 0,08 н. раствора НCl.
Решение. Вычисляем нормальность раствора гидрокарбоната кальция. Так как вещества взаимодействуют между собой в эквивалентных количествах, то можно написать V A ∙ с эк·(А) = V B ∙ с эк(B),
6,25∙0,08 = 100∙ с эк · (Ca(HCO3)2),
отсюда (Ca(HCO3)2) = 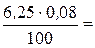 0,005 г/моль.
0,005 г/моль.
Таким образом, в 1 л исследуемой воды содержится 0,005∙1000 = 5 ммоль гидрокарбоната кальция или 5 ммоль ионов Са2+. Карбонатная жесткость воды равна 5 ммоль/л.
Пример 17. 3. Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль/л?
Решение. Из формулы 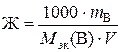 находим
находим
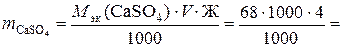 272 г,
272 г,
где 68 г/моль – М эк (CaSO4), найденная по формуле
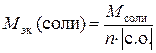 ,
,
где М – молярная масса соли, г/моль; n – число ионов металла, участвующих в реакции от каждой молекулы; |c.o. | – абсолютное значение степени окисления иона металла.
М эк(CaSO4) =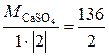 = 68 г/моль.
= 68 г/моль.
Пример 17. 4. Какую массу соды Na2CO3 надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 5 ммоль/л?
Решение. В 500 л воды содержится 500 ∙ 5 = 2500 ммоль солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2500∙53 = 132500 мг = 132,5 г соды. (53 г/моль – молярная масса эквивалентов соды Na2CO3).
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1768; Нарушение авторских прав?; Мы поможем в написании вашей работы!