
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи и упражнения для самостоятельного решения. 26.1. Привести не менее трех примеров реакций, в которых азот играет роль окислителя, и пример реакции
|
|
|
|
26.1. Привести не менее трех примеров реакций, в которых азот играет роль окислителя, и пример реакции, в которой он является восстановителем.
26.2. Привести примеры характерных для аммиака реакций присоединения и окисления без катализатора и в присутствии катализатора.
26.3. Нитрат аммония может разлагаться двумя путями:
NH4NO3 (к) = N2O (г) + 2H2O (г);
NH4NO3 (к) = N2 (г) + 1/2O2 (г) + 2H2O (г).
Какая из приведенных реакций наиболее вероятна при 298 К? Ответ подтвердить расчетом 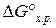 . (
. ( = –183,9 кДж/моль;
= –183,9 кДж/моль;
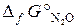 = 104,1 кДж/моль;
= 104,1 кДж/моль; 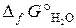 = –228,6 кДж/моль).
= –228,6 кДж/моль).
26.4. Какова реакция среды в растворах KNO3, NH4NO3, NaNO2, NH4NO2? Составить молекулярные и ионные уравнения реакций гидролиза этих солей.
26.5. Закончить уравнения реакций:
а) Zn + NaNO3 + NaOH …; б) NO + KMnO4 + H2O = …;
…; б) NO + KMnO4 + H2O = …;
в) Cu + HNO3 (разб.) …; г) AgNO3  ….
….
26.6. Написать уравнения взаимодействия разбавленной азотной кислоты с магнием, ртутью, фосфором, углем (С).
26.7. Какая масса нитрита аммония NH4NO2 требуется для получения 1 л азота при нормальных условиях? (Ответ: 2,86 г).
26.8. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? Составить уравнения реакций HNO2:
а) с HI.; б) с бромной водой (Br2).
26.9. Почему диоксид азота (NO2) способен к реакциям диспропорционирования? Написать уравнения реакций взаимодействия NO2:
а) с водой; б) гидроксидом калия.
26.10. Закончить уравнения реакций: а) N2O5 + KOH = …;
б) N2O3 + NaOH = …; в) Cu + HNO3 (разб) = …; г) NO2 + O2 + Н2О= ….
26.11. В каком газообразном соединении азот проявляет свою низшую степень окисления? Написать уравнения реакций получения этого соединения:
а) при взаимодействии хлорида аммония с гидроксидом кальция;
б) разложением нитрида магния водой.
26.12. Почему азотистая кислота способна к реакциям диспропорционирования? Написать уравнение реакции разложения НNO2, учитывая, что при этом азот приобретает степень окисления +2 и + 5.
26.13. Составить уравнения реакций окисления азотной кислотой:
а) серы до серной кислоты; б) фосфора до фосфорной кислоты Н3РО4;
в) углерода до диоксида углерода.
26.14. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
N2 → NO → NO2 → HNO3 → NH4NO3.
26.15. Закончить уравнения реакций получения аммиака:
а) H2 + N2 = …; б) NH4OH  …;
…;
в) AlN + H2O = …; г) NH4Cl + Ca(OH)2 = ….
26.16. Составить уравнения реакций последовательного получения:
N2 → NO → NO2 → HNO3 → Cu(NO3)2 → CuO → Cu.
26.17. Закончить уравнения реакций получения в промышленности азотной кислоты: а) NH3 + O2 = …; б) NO + O2 = …; в) NO2 + H2O + O2 = ….
26.18. Закончить уравнения реакций разложения азотной кислоты и ее солей:
а) HNO3  …; б) Hg(NO3)2
…; б) Hg(NO3)2  …;
…;
в) Pb(NO3)2  …; г) NaNO3
…; г) NaNO3 ….
….
26.19. Закончить уравнения реакций:
а) Na2S + NaNO2 + H2SO4 = S + NO + ….
а) KNO2 + KMnO4 + H2O = …; б) KI + HNO2 + H2SO4 = NO + …;
26.20. Какой объем 30 %-го раствора азотной кислоты (ρ = 1,18 г/мл) будет израсходован на растворение 10 г сплава, состоящего из 60 % меди и 40 % серебра, считая, что азотная кислота восстанавливается до NO? (Ответ: 53,5 мл).
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 476; Нарушение авторских прав?; Мы поможем в написании вашей работы!