
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Опыт 1. Получение этилена и его свойства
|
|
|
|
Выполнение работы
Опыт 1. Получение этилена и его свойства
(Проводить в вытяжном шкафу!). В пробирку налить 1–1,5 мл этилового спирта и 5 мл концентрированной серной кислоты (ρ = 1,84 г/мл). Укрепить пробирку в зажиме штатива, закрыть ее пробкой с газоотводной трубкой, конец которой поместить в пробирку с разбавленной бромной водой, и нагреть. Наблюдать обесцвечивание бромной воды. Когда обесцвечивание закончится, переместить конец газоотводной трубки в пробирку со слабо окрашенным раствором КMnO4. Когда раствор обесцветится, вынуть из него трубку и после этого прекратить нагревание.
Требования к результатам опыта
1. Написать уравнение реакции получения этилена.
2. Закончить уравнения реакций: CН2=CН2 + Br2 → …;
C2Н4 + КMnO4 + H2SO4 → ….
3. Cделать вывод, какие типы реакций характерны для алкенов.
Опыт 2. Ацетилен и его свойства
(Проводить в вытяжном шкафу!). В небольшую колбу налить на ⅔ ее объема воды, закрепить ее в штативе, бросить в нее небольшой кусочек карбида кальция СаС2, быстро закрыть отверстие пробирки пробкой с газоотводной трубкой и, опустив конец последней в пробирку с бромной водой, пропустить через бромную воду ток ацетилена. Что происходит с окраской раствора? Пропустить ток ацетилена через подкисленный раствор перманганата калия. Как изменилась окраска раствора?
Требования к результатам опыта
1. Написать уравнение реакции получения ацетилена при взаимодействиии карбида кальция с водой.
2. Записать уравнения реакций между ацетиленом и бромом (промежуточным продуктом является дибромэтилен, конечным − тетрабромэтан).
3. Закончить уравнение реакции C2H2 + KMnO4 + H2SO4 → …, принимая, что конечными продуктами реакции являются муравьиная кислота НСООН, диоксид углерода, сульфат марганца (II), сульфат калия и вода.
4. Cделать вывод, какие типы реакций, характерны для алкинов.
Опыт 3. Свойства бензола
(Проводить в вытяжном шкафу!). В две пробирки налить 1–2 мл бензола, в одну пробирку прилить 1–2 мл бромной воды, в другую пробирку – 1–2 мл раствора перманганата калия, подкисленного серной кислотой, пробирки встряхнуть.
Требования к результатам опыта
1. Записать наблюдения. Объяснить, почему растворы бромной воды и перманганата калия не обесцвечиваются при добавлении бензола.
2. Охарактеризовать способность бензола к реакциям присоединения и окисления, присущим непредельным углеводородам.
Пример 28.1. Написать уравнения реакций, при помощи которых из метана и неорганических реагентов можно получить бутан.
Решение. Бромированием метана можно получить бромметан:
CH4 + Br2 → CH3Br + HBr.
При нагревании бромметана с натрием образуется этан:
2CH3Br + 2Na → C2H6 + 2NaBr.
При взаимодействии этана с бромом образуется бромэтан:
C2H6 + Br2 → C2H5Br + HBr.
Бутан получается из бромэтана по реакции Вюрца:
2C2H5Br + 2Na → C4H10 + 2NaBr.
Пример 28.2. При сжигании газообразного углеводорода объемом 2,24 л было получено оксида углерода (IV) массой 13,2 г и воды массой 7,2 г. Плотность газа по воздуху составляет 1,52 (условия нормальные). Определить молекулярную формулу газа.
Решение. Молярная масса газа равна:
М (возд.) = 29 г/моль; D возд.(газа) = 1,52;
М (газа) = 29 г/моль ∙ 1,52 = 44 г/моль.
Масса углерода и водорода в 2,24 л углеводорода составляет:
12 г углерода образует 44 г СО2
х г углерода образует 13,2 г СО2 х = 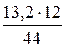 = 3,6 г С;
= 3,6 г С;
2 г водорода образует 18 г Н2О
y г водорода образует 7,2 г Н2О у =  0,8 г Н.
0,8 г Н.
Масса углерода и водорода в сожженном газе составляет
3,6 + 0,8 = 4,4 г.
Рассчитаем массу 2,24 л углеводорода:
44 г углеводорода занимает объем 22,4 л
х г углеводорода занимает объем 2,24 л х =  4,4 г.
4,4 г.
Итак, газ состоит только из углерода и водорода. Следовательно,
С:Н = 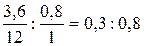 = 1:2,66,
= 1:2,66,
откуда простейшая формула СН2,66 (М = 14,66). Отношение истинного соединения к массе простейшего соединения составляет 
 . Значит, простейшую формулу надо увеличить в 3 раза, откуда истинная формула газа С3Н8.
. Значит, простейшую формулу надо увеличить в 3 раза, откуда истинная формула газа С3Н8.
Пример 28.3. Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
этиловый спирт → Х → Y → Z → бутен-1
Указать условия протекания реакций.
Решение. При нагревании этилового спирта до 180–200 °С с концентрированной серной кислотой должен образоваться продукт, реагирующий с бромоводородом. Это этилен (вещество Х). Уравнение реакции
С2Н5ОН  С2Н4 + Н2О.
С2Н4 + Н2О.
В результате присоединения бромоводорода к этилену образуется бромэтан (вещество Y):
С2Н4 + НBr → C2H5Br.
При нагревании бромэтана в присутствии натрия образуется бутан (Z)
C2H5Br + 2Na → C4H10 + 2NaBr.
Дегидрирование бутана в присутствии катализатора, например никеля – один из способов получения алкенов, в частности бутена-1.
CH3−CH2−CH2−CH3  CH2=CH−CH2−CH3 + Н2
CH2=CH−CH2−CH3 + Н2
Пример 28.4. Написать уравнения реакций, которые надо провести для осуществления следующих превращений:
циклогексан → бензол → толуол → бензойная кислота.
Указать условия протекания реакций.
Решение. Циклогексан превращается в бензол при пропускании его паров над нагретым платиновым катализатором:
С6Н12 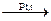 С6Н6 + 3Н2.
С6Н6 + 3Н2.
Ввести алкильную группу в бензольное кольцо можно действием галогеналкила в присутствии хлорида алюминия:
C6H6 + CH3Cl  C6H5−CH3 + HCl.
C6H5−CH3 + HCl.
При действии раствора перманганата калия на толуол образуется бензойная кислота:
C6H5−CH3 + 3[O]  C6H5−COOH + H2O.
C6H5−COOH + H2O.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1304; Нарушение авторских прав?; Мы поможем в написании вашей работы!