
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фундаментальное уравнение адсорбции Гиббса
|
|
|
|
Адсорбция относится к поверхностным явлениям и протекает самопроизвольно. Концентрация веществ на поверхности раздела фаз происходит до достижения равновесия между процессами адсорбции и десорбции (см. рис. 4.1).
Для нахождения условий протекания самопроизвольного равновесного процесса обратимся к основам химической термодинамики. Адсорбция идет самопроизвольно, когда имеет место уменьшение энергии Гиббса, т.е. dG < 0. Согласно условию (2.1) для изобарно-изотермического процесса в отсутствие изменений площади поверхности раздела фаз и заряда поверхности (dТ = 0, dp = 0, dB = 0 и dq = 0) можно записать
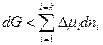 . (4.6)
. (4.6)
Для однокомпонентной системы получим
dG < Δμdn, или ΔG < ΔμΔn. (4.7)
Если обозначить химический потенциал i-гo компонента в объеме адсорбтива через (μiV) и на поверхности адсорбента (μiВ), то согласно согласно (4.7) изменение энергии Гиббса определится по формуле
ΔG < (μiB– μiV)dni. (4.8)
Для самопроизвольных процессов (dG < 0) из условия (4.8) получим
μiV> μiB. (4.9)
Химический потенциал является фактором интенсивности любого физико-химического процесса, в том числе и адсорбции. Согласно условию (4.9) химический потенциал вещества в объеме μiVпревышает химический потенциал этого же вещества на поверхности μiB.
Процесс адсорбции будет протекать до тех пор, пока будут достигнуты равновесные условия, т.е. до достижения состояния, когда ΔG = 0, что, согласно условию (4.8), соответствует равенству химических потенциалов адсорбтива и адсорбата (μiV= μiB). В условиях равновесия скорости адсорбции и десорбции становятся равными.
На основании этого адсорбцию можно определить как процесс выравнивания химического потенциала, приводящего к росту концентрации компонентов на границе раздела фаз по сравнению с их концентрацией в объеме.
Для изобарно-изотермического процесса, когда dT = 0, dp = 0, dq = 0, с учетом всех компонентов системы в условиях равновесия (dG = 0) из уравнения (2.1) получим
μidni+ σdB = 0. (4.10)
Это уравнение связывает поверхностное натяжение с процессами, протекающими на границе раздела фаз. В нем экстенсивные величины стоят под знаком дифференциала (dniи dВ). Для однородной функции первой степени относительно экстенсивных величин можно воспользоваться теоремой Эйлера, которая позволяет интегрировать это уравнение при постоянных значениях коэффициентов интенсивных величин (μiи σ) при дифференциалах.
Напомним, что согласно теореме Эйлера любая однородная функция степени k, имеющая непрерывные частные производные, удовлетворяет равенству
f/x(x,y,z)x + f/y(x,y,z)y + f/z(x,y,z)z = kf(x,y,z).
Однородной называется функция, если при умножении всех ее аргументов на множитель она приобретает этот же множитель в k-й степени, т.е. f(tx1,..., txm) = fk(x1,..., xm).
Таким образом, если состав поверхностного слоя не изменяется, что соответствует конечному значению В и ni, то можно записать
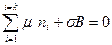 . (4.10, a)
. (4.10, a)
Полный дифференциал от всех переменных уравнения (4.10, а) выглядит так:
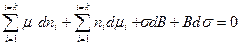 . (4.11)
. (4.11)
Из уравнения (4.11) вычтем уравнение (4.10), в результате получим
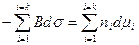 . (4.12)
. (4.12)
Используя уравнение (4.4) для выражения адсорбции, вместо формулы (4.12) можно записать
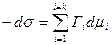 ;
; 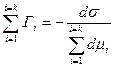 . (4.13)
. (4.13)
Это уравнение называют фундаментальным уравнением адсорбции Гиббса.
В случае адсорбции только одного компонента уравнение (4.13) упрощается:
–dσ = Гdμ; Г = –dσ/dμ. (4.14)
Уравнения (4.13) и (4.14) справедливы для всех видов адсорбции; они показывают, что при адсорбции происходит самопроизвольное снижение удельной свободной поверхностной энергии (поверхностного натяжения) по мере изменения химического потенциала.
Адсорбция определяется избытком концентрации адсорбива с и обусловлена изменением поверхностного натяжения σ, которое зависит от температуры (см. параграф 2.3). Все величины, определяющие адсорбцию, взаимосвязаны, т.е. Г = f(c, σ, Т). Для нахождения этой зависимости воспользуемся уравнениями (4.13), в которых dσ характеризует уменьшение поверхностного натяжения в результате самопроизвольного процесса при адсорбции; Гiопределяет адсорбцию количественно, а dμiпоказывает возможность и интенсивность самопроизвольного процесса в результате изменения химического потенциала.
Используя уравнения (4.13), определим адсорбцию одного i-гo компонента из смеси веществ:
Гi= – (д σ/ д μi)μ1, …, μi–1, μi+1,..., μk. (4.15)
Адсорбция одного компонента i согласно условию (4.15) есть частная производная от поверхностного натяжения (удельной свободной поверхностной энергии) по изменению химического потенциала при постоянных химических потенциалах других компонентов.
Для нахождения химического потенциала воспользуемся следующим соотношением:
μi= μi0+ RTlnc, (4.16)
где μi, μi0– равновесный и стандартный химический потенциал адсорбтива; с – концентрация адсорбтива.
Если адсорбтив является сильным электролитом и его концентрация значительна, то вместо концентрации в этом уравнении следует использовать активность а.
Дифференцируя уравнение (4.16) и учитывая, что μi0есть величина постоянная, получим
dμi= RTdlnc = RT(dc/c). (4.17)
Заменив dμiв уравнении (4.13), подставив полученное выражение для dμiв уравнение (4.17), получим
Г = – (с/RT)(dσ/dc). (4.18)
Уравнение (4.18) непосредственно следует из фундаментального уравнения адсорбции Гиббса (4.14) и характеризует влияние на избыточную адсорбцию концентрации адсорбтива и температуры, а также изменение поверхностного натяжения (удельной свободной поверхностной энергии) в зависимости от концентрации адсорбтива. Оно справедливо для всех видов адсорбции.
Таким образом, уравнение (4.18) связывает между собой основные параметры, характеризующие адсорбцию (Г, с, Т и σ), и определяет результат самопроизвольного процесса за счет снижения поверхностного натяжения. Обычно рассматривают зависимость адсорбции от концентрации адсорбтива, что и будет использовано в дальнейшем.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1644; Нарушение авторских прав?; Мы поможем в написании вашей работы!