
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие в химико-технологических процессах
|
|
|
|
Всякая обратимая реакция, лежащая в основе ХТП, при неизменяющихся условиях ее осуществления стремится к равновесию, при котором скорости образования и расходования веществ, участвующих в данной реакции, становятся одинаковыми. Равновесие системы характеризуется вполне определенными концентрациями участвующих в реакции веществ и, следовательно, показывает, какое количество целевого продукта можно получить в данном процессе из заданного количества исходного реагента. Установившееся равновесие можно нарушить, изменив условия, при которых находится система (температуру, давление или концентрацию одного из веществ). При изменившихся условиях возможно установление нового равновесия.
Направление смещения равновесия может быть оценено с помощью принципа Ле-Шателье: если на систему, находящуюся в равновесии, будет оказано внешнее воздействие, выводящее ее из равновесия, то система самопроизвольно будет стремиться уменьшить оказываемое на нее внешнее воздействие.
Рассмотрим произвольную обратимую реакцию
aA+bB n rR±Q, (15.1)
где а, b, r — стехиометрические коэффициенты; Q — тепловой эффект.
Принцип Ле-Шателье утверждает, что положение равновесия реакции (15.1) можно сместить вправо одним из следующих способов: повышением температуры, если Q<0; понижением температуры, если Q> 0; увеличением концентрации A и В или уменьшением концентрации R; увеличением давления, если объем образующегося продукта R меньше суммы объемов исходных веществ А и В; уменьшением давления, если объем образующегося продукта R больше суммы объемов исходных веществ А и В.
Всякое положение равновесия может быть количественно охарактеризовано значением константы равновесия 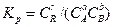
где СR, CA, СB — равновесные концентрации веществ, участвующих в реакции (15.1).
|
|
|
|
|
Дата добавления: 2014-10-22; Просмотров: 486; Нарушение авторских прав?; Мы поможем в написании вашей работы!