
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Визначення рівноважних концентрацій за вихідними концентраціями
|
|
|
|
Визначення константи рівноваги
Задача 3. Обчислити константу рівноваги длязворотної реакції

якщо рівноважні концентрації дорівнюють: [СО] = 0.02 моль/дм3; [Н2О] = 0.03 моль/дм3; [СО2] = 0.012 моль/дм3; [Н2] = 0.05 моль/дм3?
Розв’язання:
Константа рівноваги обчислюється за формулою:
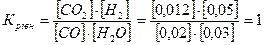
Відповідь: Крівн = 1
Задача 4. Константа рівноваги гомогенної реакції
2H2S(г)+3О2(г)=2Н2О(г)+2SO2(г)
дорівнює 1, а рівноважні концентрації дорівнюють: [Н2S] = 2 моль/дм3; [О2] = 4 моль/дм3; [Н2О] = 4 моль/дм3. Чому дорівнює рівноважна концентрація оксиду сірки?
Розв'язання: Позначимо концентрацію SO2 через х та підставляємо всі значення у рівняння для константи рівновагі
 тоді маємо
тоді маємо
Розв'язуючи це рівняння, отримуємо х = 4.
Відповідь: 4 моль/дм3.
Принцип зміщення рівноваги (принцип Ле Шательє)
Якщо змінити умови, за яких система перебуває у стані
рівноваги, то рівновага зміститься у напрямку процесів, які
протидіють цій рівновазі.
1. При підвищенні тиску рівновага зміститься у бік перебігу
реакції, внаслідок якої зменшується об'єм газів.
2. При підвищенні температури рівновага зміститься у бік
перебігу ендотермічної реакції.
3. При збільшенні концентрації вихідних речовин рівновага
зміститься у бік утворення продуктів реакції.
Оскільки збільшення об'єму у декілька разів дорівнює
зменшенню тиску у те саме число разів, збільшення об'єму
системи змістить рівновагу у бік зменшення об'єму газів.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 667; Нарушение авторских прав?; Мы поможем в написании вашей работы!