
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Математическое выражение 2-го закона термодинамики. Три составляющие изменения энтропии термодинамической системы
|
|
|
|
Энтропия равновесного процесса S- это функция состояния и ее дифференциал dS- полный дифференциал
 , [
, [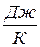 ] и
] и  , [
, [ ].
].
Температура Т на границе ТС, где подводится теплота, есть интегрирующий делитель, превращающий неполный дифференциал – теплоту в полный дифференциал – энтропию. Для равновесного кругового процесса ∮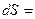 ∮
∮ - интеграл Клаузиуса.
- интеграл Клаузиуса.
У всякой ТС существует однозначная функция состояния – энтропия, которая при адиабатных равновесных процессах не изменяется.
Для сложной открытой ТС, которая взаимодействует с окружающей средой, изменение энтропии dS связано с подводом теплоты 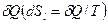 , с протеканием процессов внутри ТС
, с протеканием процессов внутри ТС  и с подводом массы вещества
и с подводом массы вещества  :
:
 , Дж/К.
, Дж/К.
Для процессов, протекающих внутри ТС, 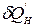 - «некомпенсируемая теплота» (Клаузиус), в которую превращается количество работы вследствие необратимости (неравновесности) процессов внутри системы.
- «некомпенсируемая теплота» (Клаузиус), в которую превращается количество работы вследствие необратимости (неравновесности) процессов внутри системы.
Если границу ТС пересекают несколько веществ с массами mi, то изменение энтропии за счет ее подвода извне будет равно:
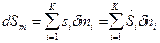 .
.
Для обратимых процессов при подводе теплоты  извне изменение энтропии ТС равно изменению энтропии окружающей среды с обратным знаком, т.е.
извне изменение энтропии ТС равно изменению энтропии окружающей среды с обратным знаком, т.е.
 ,
,
а в случае необратимых процессов

При протекании процессов внутри ТС энтропия может только расти, т.е. dSin >0.
При этом количество энергии упорядоченного движения частиц, которое диссипировало в тепловую энергию, равно: 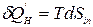 . Тогда математическое выражение второго закона термодинамики для сложной открытой ТС примет вид:
. Тогда математическое выражение второго закона термодинамики для сложной открытой ТС примет вид:
 ,
,
где знак «=» для равновесных процессов, а знак «>» для неравновесных процессов.
Знак неравенства показывает, что изменение энтропии больше величины 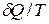 .
.
Для закрытой ТС dSm =0 и математическое выражение 2-го закона термодинамики будет иметь вид:
 .
.
Для неравновесного кругового процесса
∮ , т.е. круговой интеграл по неравновесному пути не определяет изменение энтропии в круговом процессе (цикле), а меньше его. (Для равновесного кругового процесса ∮
, т.е. круговой интеграл по неравновесному пути не определяет изменение энтропии в круговом процессе (цикле), а меньше его. (Для равновесного кругового процесса ∮ ).
).
В качестве примера, характеризующего возрастание энтропии при неравновесных процессах, рассмотрим самопроизвольный переход теплоты от горячего тела №1 с температурой Т 1 к холодному телу №2 с температурой Т 2, приведя их в контакт и рассматривая систему из этих тел, как изолированную ТС, в соответствии со следующей схемой:

Изменение энтропии этой изолированной ТС будет равна сумме изменений энтропий тел №1 и №2 т.к. энтропия - величина аддитивная:
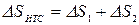 ,
,
или  ,
,
где знак минус перед q/T1 означает, что тело №1 отводит теплоту, а знак плюс перед q/T2 означает, что к телу №2 подводится теплота.
Так как Т1>Т2, то  , т.е. в результате неравновесного теплообмена энтропия ИТС возрастает.
, т.е. в результате неравновесного теплообмена энтропия ИТС возрастает.
Для равновесного перехода теплоты от тела №1 к телу №2 необходим посредник – термодинамическое рабочее тело (ТРТ), которое могло бы совершать обратимый цикл Карно, взаимодействуя с телами №1 и №2, как с источником теплоты и холодильником. Тело №3 – аккумулятор работы, который равновесно воспринимает от рабочего тела механическую работу. Тогда  , где
, где 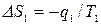 ,
, 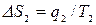 ,
,  , т.к. совершив цикл, ТС возвращается в исходное состояние, и
, т.к. совершив цикл, ТС возвращается в исходное состояние, и  , т.к. тело №3 не участвует в теплообмене.
, т.к. тело №3 не участвует в теплообмене.

Тогда  (с учетом знаков, принятых в термодинамике). Для цикла Карно известно, что термический коэффициент полезного действия цикла равен
(с учетом знаков, принятых в термодинамике). Для цикла Карно известно, что термический коэффициент полезного действия цикла равен  , или
, или  , т.е. сумма приведенных теплот цикла Карно равна нулю. Следовательно, изменение энтропии ИТС
, т.е. сумма приведенных теплот цикла Карно равна нулю. Следовательно, изменение энтропии ИТС .
.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 715; Нарушение авторских прав?; Мы поможем в написании вашей работы!