
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение первого закона термодинамики для сложной открытой системы в общем виде
|
|
|
|
В соответствии с законом сохранения и превращения энергии внутренняя энергия изолированной системы (ИС) сохраняется при протекании любых процессов внутри ТС (обратимых и необратимых). При этом энергия может передаваться от одних тел к другим телам лишь внутри ИС с сохранением или изменением формы движения материи.
В термодинамике рассматриваются ТС, которые взаимодействуют с телами окружающей среды, обмениваясь с ними теплотой, различными видами работ и веществом. В этом случае внутренняя энергия ТС будет изменяться. Тогда уравнение первого закона термодинамики для открытой сложной ТС будет иметь вид:
 , Дж,
, Дж,
где  - порция подводимой к ТС теплоты
- порция подводимой к ТС теплоты  ;
;  - порция различных видов работ, совершаемых ТС
- порция различных видов работ, совершаемых ТС  ;
;  - порция внутренней энергии, подводимой в ТС вместе с массой
- порция внутренней энергии, подводимой в ТС вместе с массой  .
.
Таким образом, первый закон термодинамики можно сформулировать так: «Запас внутренней энергии ТС может изменяться за счет подвода теплоты, совершения различных видов работ и массообмена с окружающей средой».
Запас энергии ТС состоит из:
- запаса внутренней энергии, связанной с собственными внутренними свойствами термодинамической системы -  ;
;
- запаса энергии, зависящей от внешних условий. Если на ТС воздействуют внешние силовые поля, то часть полной энергии составит потенциальная энергия. Если ТС, как целое, совершает движение, то в состав полной энергии входит кинетическая энергия ТС.
При рассмотрении открытых систем их потенциальная и кинетическая энергии вводятся в уравнение первого закона термодинамики в виде самостоятельных членов дополнительно к внутренней энергии.
Таким образом, внутренняя энергия ТС – это та часть полного запаса энергии ТС, которая не связана с положением термодинамической системы в поле внешних сил и с ее движением относительно тел окружающей среды и является функцией состояния неподвижной замкнутой системы:
 .
.
Дифференциал внутренней энергии  - полный дифференциал. Изменение внутренней энергии в конечном процессе 1-2 определяется состоянием ТС в начале и в конце процесса и не зависит от пути процесса:
- полный дифференциал. Изменение внутренней энергии в конечном процессе 1-2 определяется состоянием ТС в начале и в конце процесса и не зависит от пути процесса:
 .
.
Порция теплоты  характеризует термическое воздействие. Если внутренняя энергия ТС при этом возрастает, то
характеризует термическое воздействие. Если внутренняя энергия ТС при этом возрастает, то  , т.е. порция теплоты считается положительной.
, т.е. порция теплоты считается положительной.
Величина  в уравнении 1-го закона термодинамики характеризует воздействия, называемыми работой, и записывается в виде суммы:
в уравнении 1-го закона термодинамики характеризует воздействия, называемыми работой, и записывается в виде суммы:
 ℒ,
ℒ,
где  - работа расширения или объемной деформации ТС рассматривается отдельно от прочих видов работ;
- работа расширения или объемной деформации ТС рассматривается отдельно от прочих видов работ; 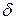 ℒ - работы немеханического характера и другие виды механической работы за исключением работы расширения.
ℒ - работы немеханического характера и другие виды механической работы за исключением работы расширения.
Если ТС совершает работу над окружающей средой с уменьшением величины внутренней энергии, то работа считается положительной, т.е. 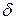 L>0 и
L>0 и 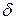 ℒ>0.
ℒ>0.
Для простой (число степеней свободы N=2), закрытой ТС ( ,
,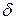 ℒ=0,
ℒ=0,  ) уравнение 1-го закона термодинамики имеет вид:
) уравнение 1-го закона термодинамики имеет вид:
 , Дж.
, Дж.
Если ТС представляет собой однородное рабочее тело, свойства которого не изменяются в объеме ТС, то можно использовать удельные величины и записать уравнение 1-го закона термодинамики в виде:
 , Дж/кг.
, Дж/кг.
В конечном процессе 1-2 работа расширения равна:  , где
, где  - уравнение процесса. Таким образом, работа расширения – функция процесса и
- уравнение процесса. Таким образом, работа расширения – функция процесса и 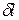 - неполный дифференциал. Для кругового процесса (цикла) работа цикла не равна нулю:
- неполный дифференциал. Для кругового процесса (цикла) работа цикла не равна нулю:
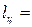 ∮
∮ ∮
∮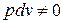 .
.
Для сложных ТС необходимо учитывать другие виды работ (работы немеханического характера и механические работы при деформации других видов, кроме объемной) - 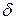 ℒ. При этом элементарная работа любого вида выражается как произведение обобщенной силы Xi на изменение обобщенной координаты dxi:
ℒ. При этом элементарная работа любого вида выражается как произведение обобщенной силы Xi на изменение обобщенной координаты dxi: 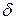 ℒ= Xidxi. Например:
ℒ= Xidxi. Например:
- механическая работа при повороте вала машины
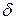 ℒМ=МDd
ℒМ=МDd ,
,
где MD – крутящий момент на валу; d - элементарный угол поворота вала;
- элементарный угол поворота вала;
- электрическая работа – работа переноса электрического заряда в электрической цепи:
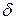 ℒ эл =
ℒ эл = ,
,
где Еэл – напряженность электрического поля; dlэл – количество перенесенного электричества;
- магнитная работа – работа намагничивания магнетика в магнитном поле:
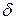 ℒ маг =
ℒ маг = ,
,
где Нмаг – напряженность магнитного поля, Ммаг – магнитный момент.
Теплоту можно выразить через энтропию S. Энтропия S [Дж/К] - функция состояния, введенная в термодинамику Р. Клаузиусом в 1865г., дифференциал которой dS является полным дифференциалом.
Тогда элементарная порция теплоты будет равна:
 , Дж,
, Дж,
где температура Т играет роль обобщенной силы, а изменение энтропии dS – роль обобщенной координаты.
Удельное количество теплоты
 , Дж/кг,
, Дж/кг,
где ds, [Дж/кгК] – удельная энтропия.
Для конечного процесса 1-2 теплота
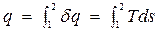 ,
,
где T=T (s) – уравнение процесса.
Количество теплоты q зависит от пути процесса и порция теплоты 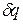 не является полным дифференциалом. Для кругового процесса (цикла) теплота цикла не равна нулю
не является полным дифференциалом. Для кругового процесса (цикла) теплота цикла не равна нулю
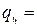 ∮
∮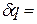 ∮
∮ ,
,
И для простой закрытой системы
∮ ∮
∮ ∮
∮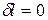 , т.е.
, т.е. 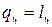 .
.
В открытую ТС вместе с массой  подводится внутренняя энергия и производится работа ввода массы
подводится внутренняя энергия и производится работа ввода массы 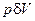 , т.е.
, т.е.
 , Дж,
, Дж,
где  по определению;
по определению;  - удельная энтальпия, Дж/кг.
- удельная энтальпия, Дж/кг.
 - энтальпия ТС, Дж.
- энтальпия ТС, Дж.
Энтальпия Н – это функция состояния, введенная в термодинамику Гиббсом, и ее дифференциал – полный дифференциал.
 .
.
Энтальпия – это сумма внутренней энергии и работы проталкивания.
Если границу ТС пересекают различные вещества, то
 , Дж.
, Дж.
Умножив и разделив это выражение на молярную массу 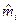 , кг/моль, получим другое выражение для величины
, кг/моль, получим другое выражение для величины  :
:
 ,
,
где 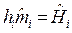 - молярная энтальпия i -го вещества, Дж/моль;
- молярная энтальпия i -го вещества, Дж/моль;  - порция количества вещества i -го компонента.
- порция количества вещества i -го компонента.
Тогда 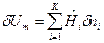 .
.
После подстановки в исходное уравнение 1-го закона термодинамики величин:
 ℒ и
ℒ и 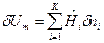 ,
,
получим уравнение 1-го закона термодинамики для сложной открытой ТС в общем виде:
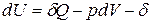 ℒ
ℒ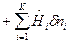 , Дж.
, Дж.
Учитывая, что  , получим выражение 1-го закона термодинамики через изменение энтальпии:
, получим выражение 1-го закона термодинамики через изменение энтальпии:
 ℒ
ℒ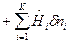 , Дж.
, Дж.
Таким образом, на основании изложенного, можно сделать следующие выводы:
1. Первый закон термодинамики устанавливает, что внутренняя энергия ТС является однозначной функцией ее состояния, которая не изменяется при отсутствии внешних воздействий при любых процессах внутри термодинамической системы (равновесных и неравновесных).
2. Работа может совершаться за счет изменения внутренней энергии и за счет сообщения системе теплоты.
3. В круговом процессе изменение внутренней энергии не происходит, и работа совершается только за счет получения системой теплоты от внешних источников.
4. Появление работы всегда сопровождается затратами других видов энергии, т.е. вечный двигатель 1-го рода неосуществим. Вечный двигатель 1-го рода – это периодически действующая машина, которая совершает работу, не заимствуя энергию извне.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 904; Нарушение авторских прав?; Мы поможем в написании вашей работы!