
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соотношения для смесей идеальных газов. Закон Дальтона
|
|
|
|
Способы задания состава смеси. Закон Амага.
Для проведения термодинамических расчетов систем с газовыми смесями или растворами необходимо знать их состав. Состав смеси может быть задан:
- массовыми долями  , где
, где 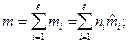
 - молярная масса i -го компонента, кг/моль; Mi – относительная молекулярная масса i -го компонента; ni – количество i -го вещества, моль;
- молярная масса i -го компонента, кг/моль; Mi – относительная молекулярная масса i -го компонента; ni – количество i -го вещества, моль;
для каждой фазы  ;
;
- молярными долями 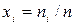 , где
, где  - количество вещества смеси, моль; для каждой фазы сумма молярных долей компонентов смеси
- количество вещества смеси, моль; для каждой фазы сумма молярных долей компонентов смеси  ;
;
- объемными долями, которые равны молярным долям  , где
, где  - объем i -го компонента смеси, который при температуре и давлении смеси газов называется приведенным объемом;
- объем i -го компонента смеси, который при температуре и давлении смеси газов называется приведенным объемом;  , м3/моль – молярный объем i-го компонента смеси. В соответствии с законом Авагадро молярные объемы всех компонентов смеси газов равны и
, м3/моль – молярный объем i-го компонента смеси. В соответствии с законом Авагадро молярные объемы всех компонентов смеси газов равны и 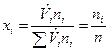 , где
, где 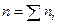 . Сумма приведенных объемов компонентов смеси газов равна объему смеси (закон Амага), т.е.
. Сумма приведенных объемов компонентов смеси газов равна объему смеси (закон Амага), т.е.  .
.
Состав смеси идеальных газов может быть также задан парциальными давлениями рi, массовыми концентрациями  и молярными концентрациями
и молярными концентрациями  .
.
При задании состава растворов пользуются массовыми и молярными концентрациями.
Парциальное давление рi – это давление i -го компонента газовой смеси при условии, что он занимает весь объем, предназначенный для смеси, при температуре смеси.
Средняя молярная масса смеси газов определяется выражением 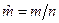 , кг/моль, где
, кг/моль, где 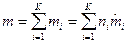 - масса смеси;
- масса смеси;  - количество вещества смеси. Тогда
- количество вещества смеси. Тогда
 .
.
Удельная газовая постоянная смеси газов
 , Дж/(кгК),
, Дж/(кгК),
где  Дж/(мольК) – молярная газовая постоянная;
Дж/(мольК) – молярная газовая постоянная; 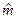 - молярная масса смеси.
- молярная масса смеси.
Закон Дальтона:
 , Па,
, Па,
т.е. сумма парциальных давлений отдельных газов, входящих в смесь, равна полному давлению смеси. Таким образом, каждый газ в сосуде занимает весь объем при температуре смеси, находясь под собственным парциальным давлением.
Уравнение состояния для смеси идеальных газов имеет вид:
 .
.
Для парциального давления и для приведенного объема i- го компонента смеси уравнения состояния имеют вид:

Тогда, разделив эти уравнения почленно первое на второе, имеем
 .
.
Разделив уравнение 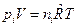 на уравнение
на уравнение  почленно, получим:
почленно, получим:
 .
.
ГЛАВА 4. ТЕПЛОЕМКОСТЬ
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 815; Нарушение авторских прав?; Мы поможем в написании вашей работы!