
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термические и калорические уравнения состояния
|
|
|
|
Термодинамические процессы и их классификация
Термодинамическим процессом называется изменение состояния ТС в результате ее взаимодействия с окружающей средой. Термодинамические процессы могут быть равновесными и неравновесными.
Непрерывная последовательность равновесных состояний образует равновесный процесс, при котором отсутствуют потери энергии на трение, завихрение, излучение и др., а ТС совершает максимальную работу против внешних сил. Равновесный процесс можно изобразить на координатной плоскости в p-V координатах графически в виде плавно сменяющихся равновесных состояний.
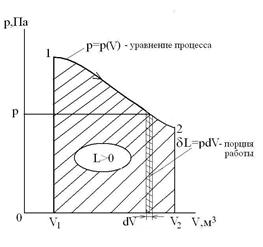
При расширении газа процесс идет с увеличением объема ТС. При этом ТС совершает работу
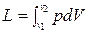 , Дж.
, Дж.
Работа расширения положительна (L >0). Процесс, идущий с уменьшением объема ТС, называется процессом сжатия. Работа, затрачиваемая на сжатие газа, отрицательна (L <0).
В термодинамике большое применение получили частные случаи термодинамических процессов: изохорный процесс, протекающий при постоянном объеме (V=const); изобарный процесс, протекающий при постоянном давлении (p=const); изотермический процесс, протекающий при постоянной температуре (T=const) и адиабатный процесс, протекающий без теплообмена ТС с окружающей средой ( и q =0).
и q =0).
Круговой процесс (цикл) – это процесс, при котором ТС, претерпев ряд изменений, возвращается в исходное состояние.
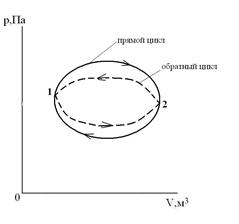
Прямой цикл – цикл тепловых двигателей, идущий в p-V координатах по часовой стрелке (линия расширения лежит выше линии сжатия). Обратный цикл – цикл холодильных установок и машин-орудий, идущий в
p-V координатах против часовой стрелки (линия расширения лежит ниже линии сжатия).
Процессы могут быть обратимыми и необратимыми. При обратимом процессе ТС, пройдя ряд состояний, может вернуться в начальное состояние через те же промежуточные состояния. При этом в ТС и окружающей среде не происходит никаких изменений. При этом процесс является равновесным, т.е. отсутствуют потери энергии на трение, теплообмен и др., а также обеспечивается механическое и термическое равновесие на границе ТС с окружающей средой (обеспечивается бесконечно малая разность давлений и температур в каждый момент процесса).
Все реальные процессы являются неравновесными и необратимыми и могут рассматриваться как равновесные и обратимые только в рамках некоторой идеализации, в рамках определенных допущений.
ГЛАВА 2 УРАВНЕНИЯ СОСТОЯНИЯ ВЕЩЕСТВА
Общее число термических и калорических уравнений состояния ТС определяется числом ее степеней свободы, т.е. числом воздействующих на ТС обобщенных сил. Эти уравнения устанавливаются опытным путем или находится методами статистической физики.
Для простой ТС (число степеней свободы N =2), на которую действует одна обобщенная сила механического характера – давление р, сопряженная внешнему параметру V, взаимодействие с окружающей средой характеризуется только одним внешним параметром, изменяющимся при данном взаимодействии, (обобщенной координатой) – объемом V и температурой Т (независимый параметр). Тогда равновесные внутренние параметры состояния: давление и внутреннюю энергию U можно выразить в виде функциональных зависимостей: p=p (V,T) – термического уравнения состояния и U=U (V,T) – калорического уравнения состояния.
Термическое уравнение состояния для простой ТС можно представить в виде связи: F (p,V,T)=0. Это уравнение является уравнением термодинамической поверхности или поверхности состояний. Для идеального газа термическим уравнением состояния является уравнение Клапейрона: pV=mRT, где R – удельная газовая постоянная.
Калорическое уравнение состояния идеального газа можно получить из закона Джоуля: «Внутренняя энергия термодинамической системы U при Т=const не зависит от объема V:
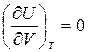 .
.
Продифференцировав уравнение U=U(V,T), получим:
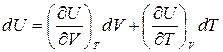 ,
,
где 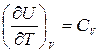 - теплоемкость идеального газа в процессе V =const (по определению).
- теплоемкость идеального газа в процессе V =const (по определению).
Тогда
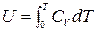 ,
,
т.е. внутренняя энергия идеального газа является функцией только температуры:
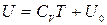 .
.
Калорическое и термическое уравнения состояния идеального газа можно также получить из молекулярно-кинетических представлений.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 1330; Нарушение авторских прав?; Мы поможем в написании вашей работы!