
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Максимальная и минимальная теплоты процесса
|
|
|
|
Уравнения первого закона термодинамики в сложных закрытых ТС при двух фиксированных параметрах имеют вид:
- для изохорно-изотермического процесса (T,V =const): 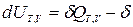 ℒТ,V ;
ℒТ,V ;
- для изобарно-изотермического процесса (T,p =const): 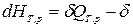 ℒТ,р.
ℒТ,р.
При написании этих уравнений использовалось правило знаков, принятое в термодинамике, т.е.  , если теплота подводится к ТС, и
, если теплота подводится к ТС, и 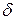 ℒ> 0, если работа совершается термодинамической системой. В термохимии принято противоположное правило знаков для теплоты, т.е. теплота
ℒ> 0, если работа совершается термодинамической системой. В термохимии принято противоположное правило знаков для теплоты, т.е. теплота  , (положительна), если она отводится от ТС. Тогда для конечных процессов 1-2 уравнение 1-го закона термодинамики будет иметь вид:
, (положительна), если она отводится от ТС. Тогда для конечных процессов 1-2 уравнение 1-го закона термодинамики будет иметь вид:
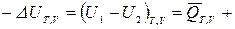 ℒТ,V, (1)
ℒТ,V, (1)
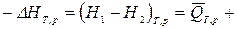 ℒТ,р, (2)
ℒТ,р, (2)
Соотношения (1) и (2) справедливы для любых процессов, обратимых и необратимых.
Для обратимого процесса ℒ=ℒ max, 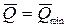 :
:
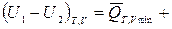 ℒТ,V max, (3)
ℒТ,V max, (3)
 ℒТ,p max, (4)
ℒТ,p max, (4)
Для максимально возможного необратимого процесса ℒ=ℒ min=0,  :
:
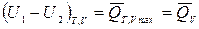 , (5)
, (5)
 . (6)
. (6)
Соотношения (5) и (6) используются в химической термодинамике для расчета изохорного и изобарного тепловых эффектов химических реакций (ТЭХР). В этом случае работа ℒ max преобразуется в тепловую энергию неупорядоченного движения частиц (в теплоту  и
и  ).
).
В случае обратимого равновесного процесса перераспределения масс (уравнения (3) и (4)) величины  и
и 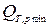 - это количества теплоты, которыми ТС обменивается с окружающей средой в процессах
- это количества теплоты, которыми ТС обменивается с окружающей средой в процессах  и
и  . ℒТ,V max и ℒТ,p max - максимальные количества работы немеханического характера, которые могут быть получены от ТС в процессах
. ℒТ,V max и ℒТ,p max - максимальные количества работы немеханического характера, которые могут быть получены от ТС в процессах 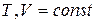 и
и  .
.
В случае необратимого процесса перераспределения массы в соответствии со вторым законом термодинамики работа ℒ max преобразуется в теплоту, количество которого равно изменению внутренней энергии  в процессе
в процессе 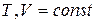 , или изменению энтальпии
, или изменению энтальпии  в процессе
в процессе  , протекающем в сложных термодинамических системах.
, протекающем в сложных термодинамических системах.
Химические реакции, при которых теплота отводится от термодинамической системы  , чтобы конечные продукты имели ту же температуру, что и начальные реагенты, называются экзотермическими химическими реакциями. Химические реакции, сопровождающиеся поглощением теплоты
, чтобы конечные продукты имели ту же температуру, что и начальные реагенты, называются экзотермическими химическими реакциями. Химические реакции, сопровождающиеся поглощением теплоты  , при T=const, называются эндотермическими химическими реакциями.
, при T=const, называются эндотермическими химическими реакциями.
Рассмотрим два примера: 1. разрядка химического источника электроэнергии (аккумулятор, батарея карманного фонаря) – процесс обратимый: ℒ Т,p max - преобразуется в электрическую энергию, а 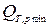 - отводится от системы. 2. Если замкнуть клеммы батареи накоротко, то получим максимально необратимый процесс: ℒ
- отводится от системы. 2. Если замкнуть клеммы батареи накоротко, то получим максимально необратимый процесс: ℒ  ,
,  .
.
ГЛАВА 8. ТЕРМОХИМИЯ
Термохимия изучает изменение состояния ТС с неоднородными рабочими телами и химическими реакциями в них, которые сопровождаются изменением состава системы и тепловыми эффектами. Термохимия изучает тепловые эффекты химических реакций (ТЭХР).
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 412; Нарушение авторских прав?; Мы поможем в написании вашей работы!