
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример решения 6.1
|
|
|
|
Согласно своему варианту записываем уравнение химической реакции, например:
K2Cr2O7 + Ti2(SO4)3 + H2SO4 = Cr2(SO4)3 + Ti(SO4)2 + H2O + K2SO4.
Уравнивание стехиометрических коэффициентов ионно-электронным методом проводим по определенному алгоритму.
1) Проставим для всех элементов степени окисления:
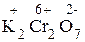 +
+ +
+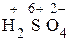 =
=  +
+  +
+  +
+ 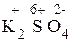 .
.
2) Выясним элементы, меняющие степень окисления в результате реакции и определим, какое вещество выполняет роль окислителя (принимает электроны), а какое – роль восстановителя (отдает электроны).
В данной реакции изменяют степени окисления элементы Cr и Ti, при этом K2Cr2O7 выполняет роль окислителя, а Ti2(SO4)3 – роль восстановителя, H2SO4 играет роль среды.
3) Запишем реакцию в ионно-электронном виде и подчеркнем окислитель и восстановитель. Для этого учитываем диссоциацию молекул на ионы, а слабые электролиты (например, Н2О, оксиды и сульфиды металлов), если они встречаются в реакции, оставляем в молекулярном виде. Получаем:
2K+ + (Cr2O7) 2- + 2Ti 3+ + 3(SO4)2- + 2H+ + (SO4)2– =
= 2Cr 3+ + 3(SO4)2- + Ti 4+ + 2(SO4)2- + H2O + 2K+ + (SO4)2-.
4) Записываем полуреакции окисления и восстановления, рассматривая только подчеркнутые частицы. Сравниваем количество основных элементов справа и слева и, при необходимости, вводим уравнивающие коэффициенты (в данном случае ставим 2 перед Ti4+).
(Cr2O7)2- → 2Cr3+;
окислитель
2Ti3+ → 2Ti4+.
восстановитель
5) Отметим число принятых электронов в полуреакции восстановления и число отданных электронов в полуреакции окисления.
(Cr2O7)2- + 6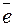
 2Cr3+;
2Cr3+;
2Ti3+ – 2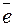
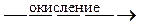 2Ti4+.
2Ti4+.
6) Проводим в каждой строчке ионное уравнивание. Баланс по кислороду проводим в виде H2O, а по водороду – в виде Н+.
В данном случае в верхней полуреакции справа вводим 7H2O, а в левую часть – добавляем 14 Н+. Во второй полуреакции изменений нет. Получаем следующее:
14Н+ +(Cr2O7)2- + 6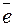 → 2Cr3+ + 7H2O;
→ 2Cr3+ + 7H2O;
2Ti3+ – 2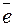 → 2Ti4+.
→ 2Ti4+.
 7) Проводим электронный баланс, принимая во внимание, что число отданных восстановителем электронов всегда равно числу электронов, принятых окислителем. Справа ставим вертикальную черту, находим наименьшее общее кратное и проставляем соответствующие коэффициенты.
7) Проводим электронный баланс, принимая во внимание, что число отданных восстановителем электронов всегда равно числу электронов, принятых окислителем. Справа ставим вертикальную черту, находим наименьшее общее кратное и проставляем соответствующие коэффициенты.
14Н+ +(Cr2O7)2- + 6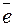 → 2Cr3+ + 7H2O; 1
→ 2Cr3+ + 7H2O; 1
2Ti3+ – 2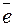 → 2Ti4+. 3
→ 2Ti4+. 3
8) Складываем левые и правые части полуреакций, умножив на соответствующие коэффициенты:
14H+ + (Cr2O7)2- + 6Ti3+ = 2Cr3+ + 7H2O + 6Ti4+.
9) Теперь под знаком равенства поставим короткую вертикальную черту и для элементов, стоящих слева, добавим связанные с ними частицы, которые раньше мы не учитывали. Как видно из 3): для (Cr2O7)2- это 2К+, для 2Ti3+ – это 3(SO4)2-, а для 2Н+ – это (SO4)2-. Те же самые частицы записываем справа от черты. Получаем следующее:
14H+ + (Cr2O7)2- + 6Ti3+ = 2Cr3+ + 7H2O + 6Ti4+;
7(SO4)2- + 2K+ + 9(SO4)2- | 7(SO4)2- + 2K+ + 9(SO4)2-.
10) Учитывая добавленные ионы, составляем полное уравнение со всеми стехиометрическими коэффициентами:
K2Cr2O7 +3Ti2(SO4)3 +7H2SO4 = Cr2(SO4)3 +6Ti(SO4)2 + 7H2O+K2SO4.
Теперь определим термодинамическую вероятность протекания данной окислительно-восстановительной реакции. Как показано в теме III, для этого необходимо провести расчет убыли свободной энергии (Δ G 0298 химической реакции).
Записываем из 7) полуреакции окисления и восстановления и, пользуясь данными Приложения 3, приводим для них справа значения электродных потенциалов (φ0):
14Н++(Cr2O7)2-  2Cr3++7H2O; φ
2Cr3++7H2O; φ = φ
= φ = +1,33 В;
= +1,33 В;
2Ti3+  2Ti4+ φ
2Ti4+ φ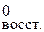 = φ
= φ = –0,04 В.
= –0,04 В.
Рассчитываем ЭДС протекающего процесса (ε0):
ε0 = φ – φ
– φ = 1,33 - (-0,04) = 1,37 В.
= 1,33 - (-0,04) = 1,37 В.
Далее рассчитываем Δ G  химической реакции:
химической реакции:
Δ G 0298 = – zF ε0,
где z – число электронов, переданных от восстановителя к окислителю. С учетом электронного баланса z = 6;
F – число Фарадея, равное 96500 Кл/моль.
Чтобы ответ получить в кДж, вводим множитель 10-3:
Δ G 0298 = -6×96500×1,37×10-3 = -793,2 кДж.
Так как Δ G 0298 < 0, то данная реакция термодинамически вероятна, т.е. может протекать в прямом направлении.
Задание 6.2. Для двух металлов (табл. VI.2), находящихся в растворах своих солей с определенной концентрацией:
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 568; Нарушение авторских прав?; Мы поможем в написании вашей работы!